Vitamin A regulates fibroblast growth factor 23 (FGF23)
Steffen Rausch Nutrition Available online 28 August 2020, 110988
Highlights
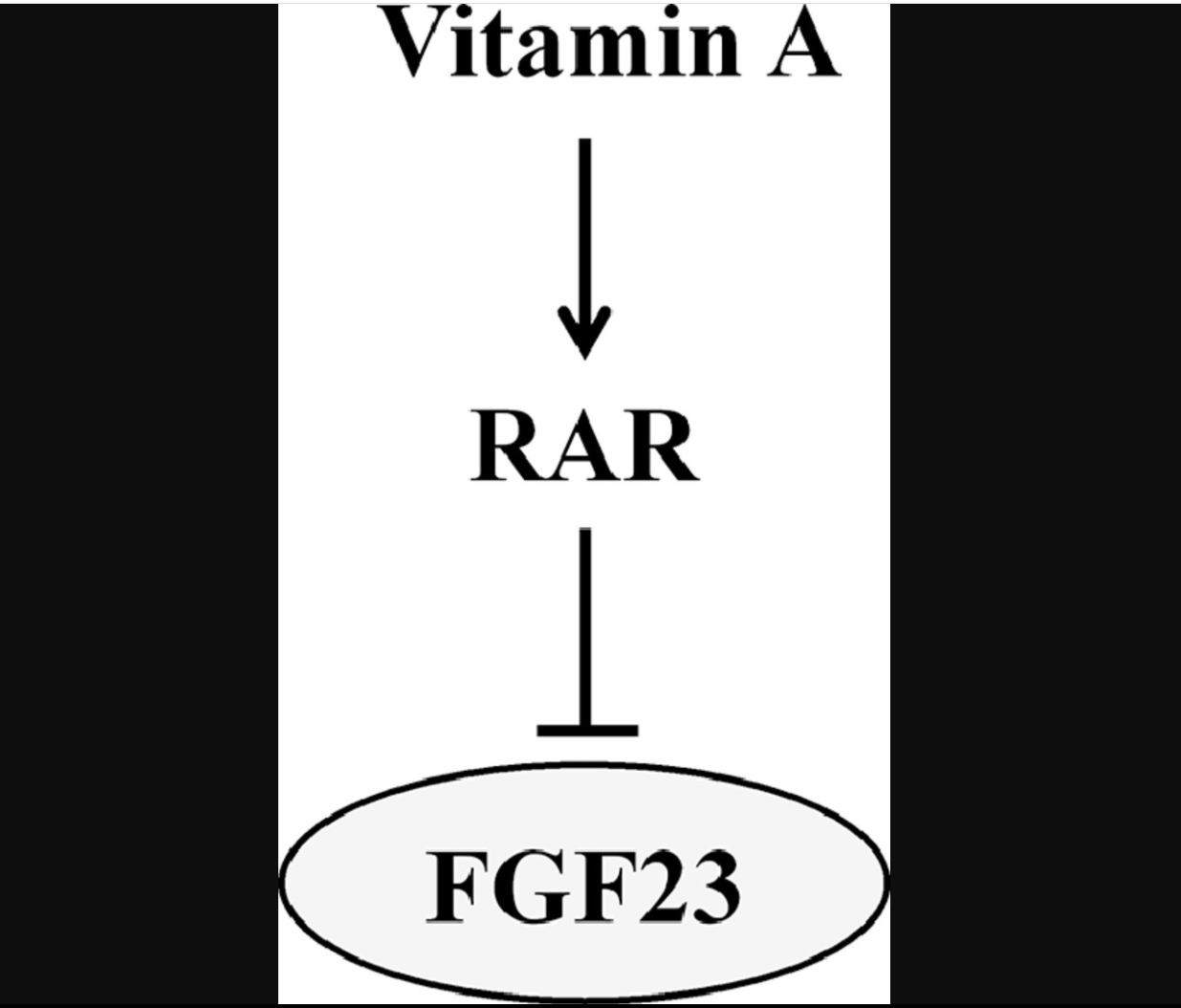
• Retinoic acid suppresses fibroblast growth factor 23 (FGF23) production.
• The effect is mediated by retinoic acid receptor (RAR).
• Dietary vitamin A, retinyl esters, mimick the retinoic acid effect on Fgf23.
• Isotretinoin, a vitamin A derivative used in the treatment of severe acne, also reduces Fgf23.
Objective
Renal phosphate and vitamin D metabolism is regulated by proteohormone fibroblast growth factor 23 (FGF23) which is secreted by bone cells. FGF23 inhibits phosphate reabsorption and the production of calcitriol, active vitamin D (1,25(OH)2D3). FGF23 generated by other cells exerts further paracrine effects in the liver, heart, and immune system. The FGF23 plasma concentration is positively associated with the onset and progression of kidney and cardiovascular diseases, disclosing FGF23 as a potential disease biomarker. The impact of vitamin A on FGF23 expression is controversially discussed. Vitamin A components, retinoids, are mainly effective through nuclear retinoic acid receptors (RAR) and exert different effects on bone.
Methods
Here, we studied the relevance of vitamin A for FGF23 production. Fgf23 transcripts were determined by qRT-PCR in UMR106 osteoblast-like cells and IDG-SW3 osteocytes. FGF23 protein in the cell culture supernatant was measured by ELISA.
Results
All-trans retinoic acid, retinyl acetate, RAR agonist TTNPB (4-[(E)-2-(5,6,7,8-Tetrahydro-5,5,8,8-tetramethyl-2-naphthalenyl)-1-propenyl]benzoic acid), and 13-cis-retinoic acid down-regulated Fgf23 gene expression in a dose-dependent manner in UMR106 cells. This effect was significantly attenuated by RAR antagonist AGN (4-[2-[5,6-Dihydro-5,5-dimethyl-8-(4-methylphenyl)-2-naphthalenyl]ethynyl]benzoic acid).
Conclusion
Our study discloses vitamin A as a potent suppressor of FGF23 production through RAR.