Les progéniteurs adipogènes gardent les cellules souches musculaires jeunes
Sara Ancel Aging 2019 Volume 11, Numéro 18 pp 7331—7333
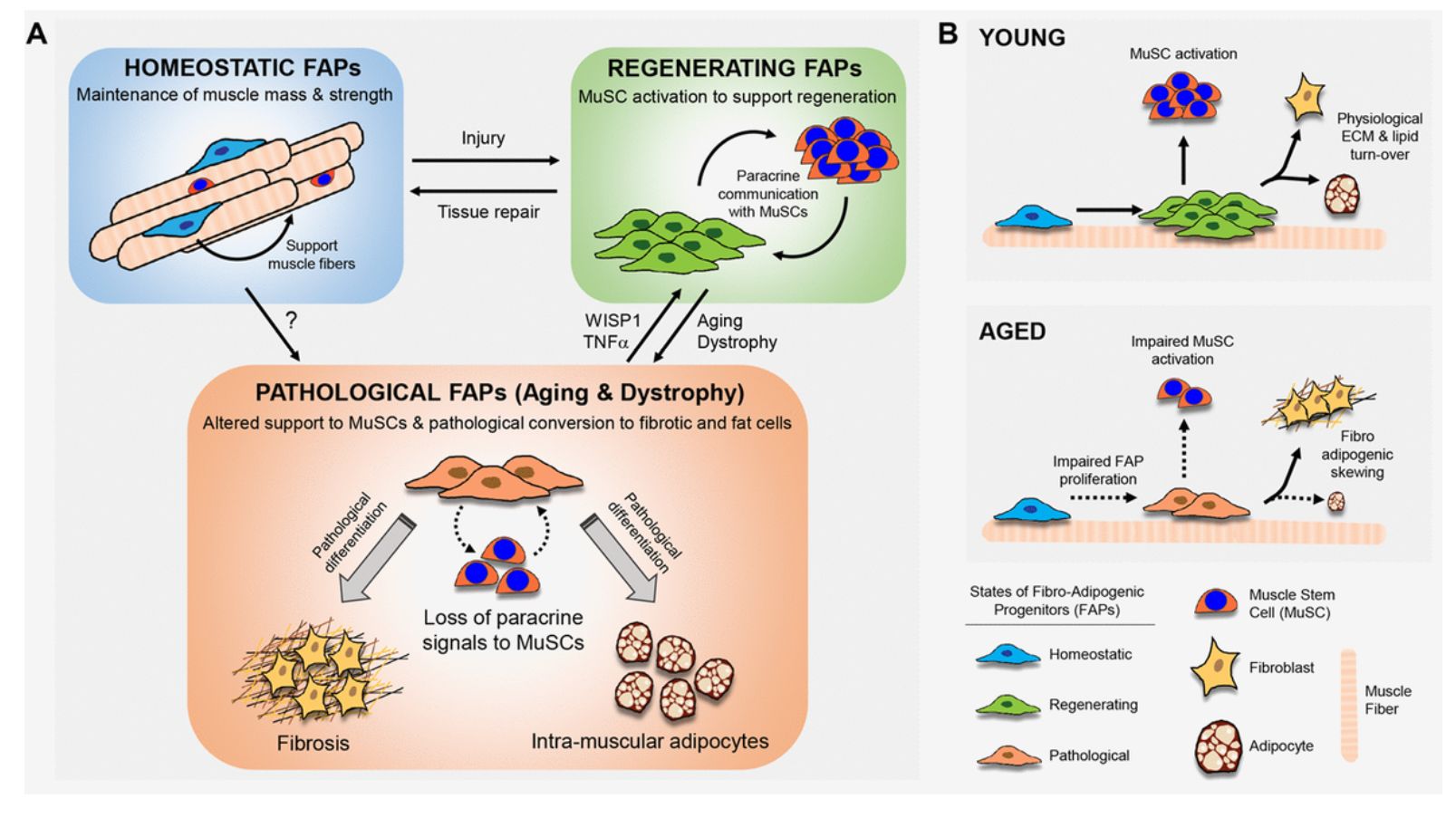
Le déclin de la fonction des cellules souches au cours du vieillissement entraîne une altération de la fonction des tissus et contribue à la réparation retardée des tissus après une lésion. Dans le muscle squelettique adulte, la perte d’intégrité de la myofibre causée par des blessures mécaniques ou des maladies est réparée par des cellules souches musculaires résidentes (cellules muqueuses), appelées cellules satellites, qui quittent rapidement la quiétude après la perturbation de l’architecture musculaire pour se développer, se différencier et stimuler la régénération tissulaire. Le destin des MuSC dépend fondamentalement de la «niche», leur environnement local, orchestré par divers éléments cellulaires et acellulaires. Le vieillissement provoque des modifications extrinsèques des cellules dans la niche de MuSC et dérègle les voies de signalisation, ce qui modifie collectivement la fonction régénératrice des MuSC [ 1]. La faible capacité de régénération des muscles âgés contribue également au développement de la fibrose en réponse à des signaux systémiques aberrants.
Les progéniteurs fibro / adipogéniques (FAP) constituent une population de cellules mésenchymateuses interstitielles dans le muscle squelettique dépourvues de potentiel myogénique, mais soutenant l'engagement des cellules souches musculaires et pouvant se différencier des lignées adipogènes ou fibrotiques ( Figure 1A) [ 2 ]. Une population «régénérative» de FAP augmente en réponse à une blessure pour fournir des signaux de support transitoires et réguler l'engagement des MuSC pendant la régénération musculaire [ 3 , 4 ]. Les maladies musculaires génétiques telles que la dystrophie musculaire de Duchenne génèrent des FAP «pathologiques» et provoquent une dysbiose entre FAP et MuSC, une capacité de régénération altérée et une infiltration musculaire du tissu adipeux et une fibrose [ 4]. Cependant, on en sait beaucoup moins sur la contribution chronique des FAP à l'homéostasie musculaire et sur l'influence du vieillissement sur le dialogue croisé entre les FAP et les MuSC.