Si ça marche, il faut acheter des actions
Pfizer présente des données de phase 2 positives sur l'alopécie areata lors d'une session de dernière minute au 27ème congrès de l'Académie européenne de dermatologie et de vénéréologie (EADV)
Samedi 15 septembre 2018 2h00
"Les personnes vivant avec l'alopécie areata font face à un parcours difficile car il n'existe actuellement aucun traitement approuvé"
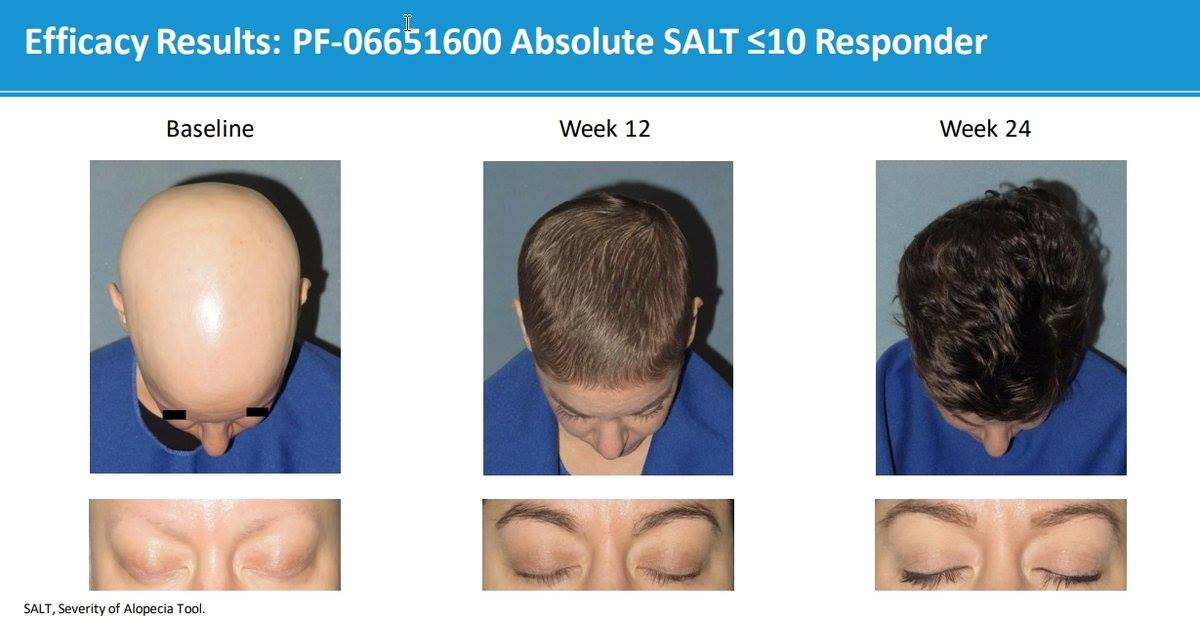
NEW YORK - ( BUSINESS WIRE) - Pfizer Inc. (NYSE: PFE) a annoncé aujourd'hui les résultats de son étude de phase 2a sur le PF-06651600, un inhibiteur oral de Janus kinase (JAK) 3 et le PF-06700841, un inhibiteur de tyrosine kinase (TYK) 2 / JAK1. par rapport au placebo, chez les patients présentant une alopécie modérée à sévère (AA), une maladie auto-immune caractérisée par une perte de cheveux et souvent associée à de profondes conséquences psychologiques. Les deux inhibiteurs de JAK ont atteint le critère principal d'efficacité en améliorant la repousse des cheveux sur le cuir chevelu par rapport aux valeurs initiales à la semaine 24 (33,6 points et 49,5 points pour JAK3 et TYK2 / JAK1, respectivement), mesuré par le score de gravité de l'alopécie (100 échelle de points).
«Nous sommes satisfaits de ces résultats et excités par le potentiel de l'inhibition de la kinase en tant que nouvelle cible thérapeutique pour les patients vivant avec l'alopécie areata. Il s'agit de la première étude bien contrôlée des inhibiteurs de JAK par voie orale dans l'alopécie areata, contribuant à améliorer notre compréhension de cette maladie présentant d'importants besoins non satisfaits et faisant progresser la science de l'inhibition de la kinase », a déclaré Michael Vincent, Ph.D. et directeur scientifique de Pfizer Inflammation and Immunology.
Sur la base de l'ensemble des données et des profils cliniques émergents, l'inhibiteur JAK3 expérimental, récemment désigné par la FDA pour le traitement de l'alopécie areata, avance à la prochaine phase de développement des AA modérés à sévères et continuera d'être évalué pour la polyarthrite rhumatoïde (PR), la maladie de Crohn (MC) et la colite ulcéreuse (CU). Le PF-06700841 continuera à être évalué pour le psoriasis (PsO), les CD et les UC.
"Les personnes vivant avec l'alopécie areata font face à un voyage difficile car il n'existe actuellement aucun traitement approuvé", a déclaré Rodney Sinclair, chercheur chez MD, Sinclair Dermatology, à Melbourne, en Australie. «Les résultats observés avec ces inhibiteurs de JAK sont très encourageants pour moi en tant que clinicien, car ils signalent une nouvelle façon de penser au traitement de l’alopécie, ce qui peut apporter de l’espoir aux patients souffrant de cette maladie.
À propos de l'étude
Cette étude multicentrique, à double insu et à répartition aléatoire, de phase 2a, évalue l'efficacité, l'innocuité et la tolérabilité du PF-06651600 et du PF-06700841 par rapport au placebo chez les patients présentant une AA modérée à sévère. Les patients ont été randomisés 1: 1: 1 pour recevoir: PF-06651600 (200 mg une fois par jour [QD] pendant 4 semaines, suivis de 50 mg QD pendant 20 semaines) ou PF-06700841 (60 mg QD pendant 4 semaines, suivis de 30 mg par jour pendant 20 semaines) ou un placebo.
L’étude a révélé que la variation moyenne ajustée par le placebo (IC à 95%) de la modification SALT par rapport aux scores de base à la semaine 24 était de 33,6 points (21,4, 45,7) (P <0,0001) pour le PF-06651600 et de 49,5 points (37,1, 61,8). (P <0,0001) pour le PF-06700841, avec une séparation statistiquement significative par rapport au placebo dès la semaine 6 et la semaine 4, respectivement.
En plus de satisfaire au critère principal d'évaluation de l'efficacité, les candidats expérimentaux ont également atteint tous les critères d'évaluation secondaires dans cette étude.
Dans l'ensemble, les taux d'événements indésirables (EI) étaient comparables entre les groupes de traitement. Les effets indésirables les plus fréquents observés dans l’étude concernaient les infections, les troubles gastro-intestinaux et les lésions cutanées / sous-cutanées. Il n'y a pas eu de cas de réactivation de l'herpès zoster.
À propos de l'alopécie areata
L'alopécie areata (AA) est une maladie auto-immune caractérisée par une perte de cheveux souvent irrégulière sur le cuir chevelu, le visage ou le corps. 1,2 Les personnes souffrant des AA éprouvent des symptômes lorsque les cellules immunitaires attaquent les follicules pileux sains, provoquant la chute des cheveux, en commençant souvent par des plaques rondes et lisses. 1,2 L'âge moyen d'apparition se situe entre 25 et 35 ans, mais il peut aussi avoir un impact sur les enfants et les adolescents, et est observé chez les deux sexes et dans toutes les ethnies. 1,2 Plus de la moitié des patients atteints d'AA ont une mauvaise qualité de vie liée à la santé et, par conséquent, la maladie peut avoir de graves conséquences psychologiques, notamment des niveaux élevés de dépression et d'anxiété. 1
Leadership de l'inhibiteur de kinase de Pfizer
On pense que les voies JAK jouent un rôle important dans les processus inflammatoires car elles sont impliquées dans la signalisation de plus de 50 cytokines et de facteurs de croissance, dont beaucoup conduisent à des conditions à médiation immunitaire. 1 L' inhibition de JAK offre la possibilité de nouvelles options de traitement avancées pour ces conditions grâce à une sélectivité unique et ciblée.
Pfizer a mis au point une capacité de recherche de pointe dans le domaine des kinases grâce à de multiples thérapies d'inhibiteurs de kinases uniques en développement. En tant que pionnier de la science JAK, la société continue de faire progresser plusieurs programmes de recherche de molécules présentant de nouveaux profils de sélectivité, lesquels, s’ils sont approuvés, pourraient potentiellement offrir des traitements de transformation aux patients. Pfizer présente les inhibiteurs de kinases suivants dans des essais portant sur plusieurs indications:
PF-06651600: Un inhibiteur de JAK 3 pour l'arthrite de la PR, la MC et la CU; PF-06651600 a reçu la désignation de thérapie innovante de la FDA pour le traitement des patients atteints de AA
PF-06700841: Inhibiteur de TYK2 / JAK1 à l'étude pour le traitement de la PsO, CD et UC
PF-04965842: Un inhibiteur sélectif de JAK1 dans des essais cliniques de phase 3 pour le traitement de la dermatite atopique (AD) 2 ; Le PF-04965842 a reçu la désignation de «Breakthrough Therapy» de la FDA pour le traitement de patients atteints de MA modérée à grave
PF-06650833: Etude d'un inhibiteur de la kinase 4 associée au récepteur de l'interleukine-1 (IRAK4) pour le traitement de la PR
PF-06826647: Inhibiteur de TYK2 à l'étude pour le traitement de l'OPS et des maladies inflammatoires de l'intestin
Travailler ensemble pour un monde plus sain ®
AVIS DE DIVULGATION: Les informations contenues dans ce communiqué datent du 15 septembre 2018. Pfizer n'assume aucune obligation de mettre à jour les déclarations prospectives contenues dans ce communiqué à la suite de nouvelles informations ou d'événements ou de développements futurs.