Traduction de l'étude
 La ferroptose est-elle un élément clé du processus conduisant à des dommages multiorganiques dans COVID-19 ?
La ferroptose est-elle un élément clé du processus conduisant à des dommages multiorganiques dans COVID-19 ?
par Anna Maria Fratta Pasini Antioxydants 2021, 10(11), 1677 ;
Même si COVID-19 est surtout connu pour affecter la pathologie respiratoire, il peut également entraîner plusieurs manifestations extrapulmonaires, entraînant des lésions multiviscérales.
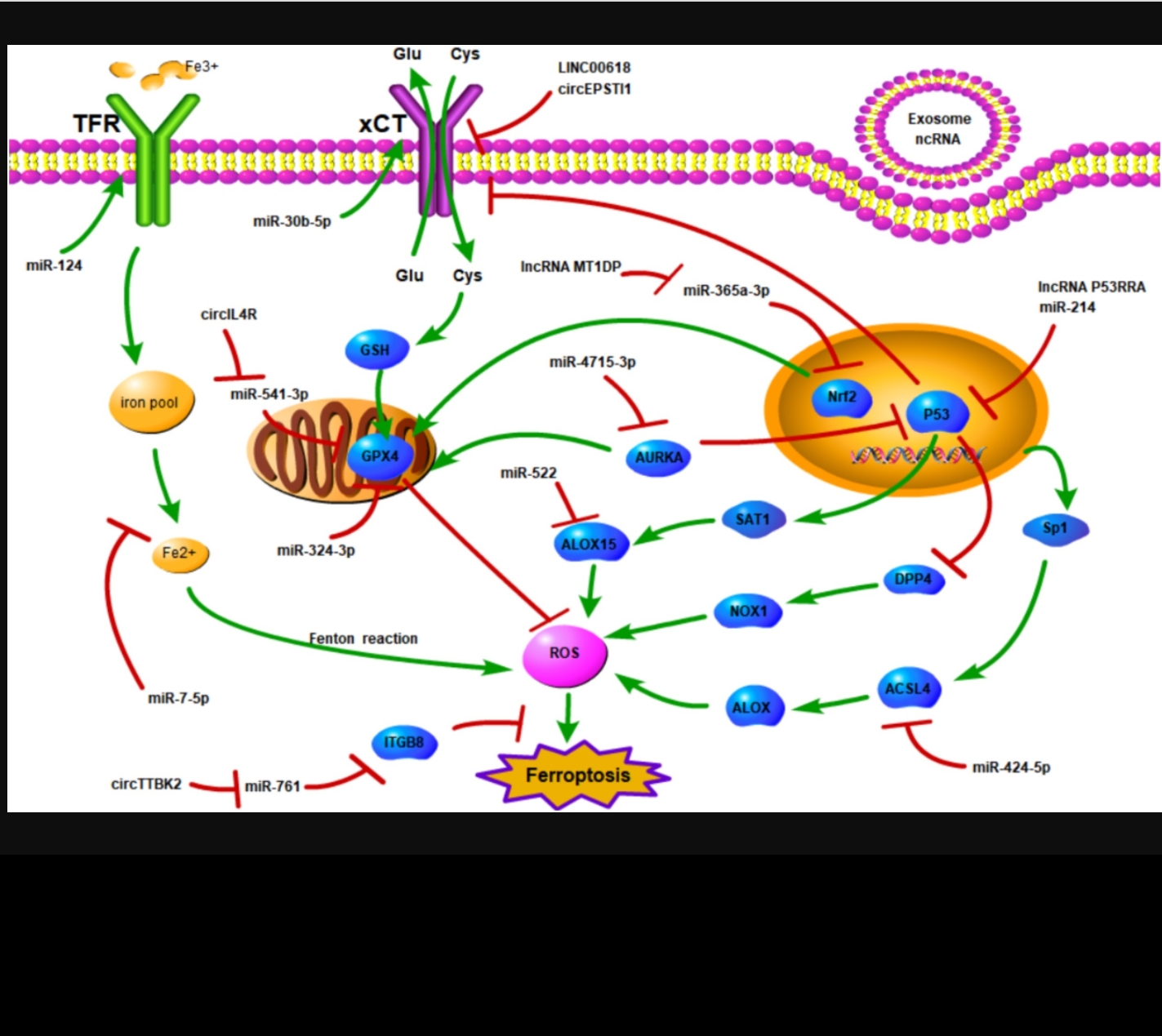
Un cas récemment rapporté de myocardite SARS-CoV-2 avec choc cardiogénique a montré une signature de ferroptose myocardique et rénale, une nouvelle mort cellulaire programmée dépendante du fer.Le terme ferroptose a été inventé au cours de la dernière décennie pour décrire la forme de mort cellulaire induite par la petite molécule d'érastine. En tant qu'inducteur spécifique de la ferroptose, l'érastine inhibe le système antiporteur cystine-glutamate Xc-, bloquant le transport dans le cytoplasme de la cystine, un précurseur du glutathion (GSH) en échange du glutamate et le dysfonctionnement conséquent de GPX4. La ferroptose est également favorisée par une surcharge en fer intracellulaire et par l'accumulation dépendante du fer de peroxydes lipidiques dérivés d'acides gras polyinsaturés (AGPI). Étant donné que l'épuisement du GSH, l'inactivation du GPX4, l'altération du métabolisme du fer et la régulation à la hausse de la peroxydation des AGPI par les espèces réactives de l'oxygène sont des signes particuliers de COVID-19, il est possible que le SRAS-CoV-2 déclenche une ferroptose dans les cellules de plusieurs organes, contribuant ainsi à des lésions multiviscérales.
Ici, nous passons en revue les mécanismes moléculaires de la ferroptose et sa relation possible avec l'infection par le SRAS-CoV-2 et les lésions multiviscérales. Enfin, nous analysons les interventions potentielles qui peuvent lutter contre la ferroptose et, par conséquent, réduire les dommages multi-organes.
Composés qui renforcent l'axe GPX4-GSH-cystéine
Quant à l'axe GPX4-GSH-cystéine, il a été montré que le sélénium (Se) préserve le GPX4 d'une inactivation irréversible en raison de son rôle dans la synthèse de la sélénocystéine [110]. De plus, il a été récemment montré que Se améliore les réponses transcriptionnelles protectrices pour réguler positivement l'expression de GPX4 et inhiber la ferroptose dans le modèle de souris AVC [111]. Curieusement, des études in vitro, animales et humaines indiquent que la carence en Se est un facteur de risque établi pour les infections virales et pour déterminer la réponse de l'hôte : en fait, il a été démontré que la supplémentation en Se détermine des avantages cliniques importants dans plusieurs infections virales, y compris le VIH-1. 112]. Fait intéressant, un lien entre le statut Se et les résultats des patients COVID-19 a également été identifié [113,114,115,116,117]. Dans l'ensemble, les données disponibles jusqu'à présent suggèrent fortement que le Se est essentiel pour la prévention de l'infection par le SRAS-CoV-2 et peut avoir un impact négatif sur les résultats du COVID-19, en particulier dans les populations où l'apport en Se est faible [113].
En rapport avec ces observations, Ebselen, un composé Se synthétique agissant principalement comme un imitateur de la peroxiredoxine et un imitateur de GPX, s'est avéré avoir la plus forte activité inhibitrice contre la protéase principale du SRAS-CoV-2 requise pour la réplication du virus [118]. Ebselen, par conséquent, grâce à son activité antioxydante médiée par la restauration de certaines sélénoprotéines, à la fois réduit la réplication virale dans les tests cellulaires [118] et inhibe la ferroptose en agissant comme un imitateur de GPX [119]. Les recherches futures devraient déterminer si cette approche est également bénéfique chez l'homme.
Comme la cystéine est le précurseur limitant la vitesse de synthèse du GSH [45,55], des niveaux de cystéine cellulaire adéquats peuvent entraver l'épuisement du GSH, permettant à GPX4 d'éliminer en continu les lipides LOOH [45,55]. La N-acétylcystéine (NAC) est un promédicament à base de cystéine qui est utilisé dans le traitement de l'insuffisance hépatique causée par l'acétaminophène, chez les patients septiques gravement malades et pour perdre du mucus épais dans la maladie pulmonaire obstructive chronique ; plus récemment, la NAC a été utilisée pour la prévention et comme traitement adjuvant chez les patients COVID-19 [120]. Fait intéressant, plusieurs études in vitro récentes ont montré que la NAC possède une activité anti-ferroptotique [121,122,123] : en particulier, il a été démontré que la NAC entrave la mort cellulaire en réponse à la ferroptose induite par l'érastine, alors que la NAC n'a pas montré d'effet protecteur sur les cellules traitées avec RAS-selective lethal 3 (RSL3), un composé qui peut provoquer une ferroptose par liaison directe à GPX4 [121]. De plus, la NAC a partiellement récupéré l'effet de l'IL-6 sur les ROS et la ferroptose dans les cellules épithéliales bronchiques [122] et la ferroptose induite par les nanoparticules dans les cellules neuronales [123]. Le NAC est donc susceptible de fonctionner comme un précurseur du GSH qui a des rôles anti-ferroptotiques en améliorant l'axe GPX4-GSH-cystéine, plutôt que de bloquer directement la phase de propagation des radicaux en tant que piégeur de radicaux. Étant donné que les résultats des études expérimentales et cliniques disponibles à ce jour indiquent que la NAC agit dans une variété de voies thérapeutiques cibles potentielles impliquées dans la physiopathologie de l'infection par le SRAS-CoV-2 [124], le fait que la NAC inhibe la ferroptose peut expliquer davantage son effet adjuvant. dans le traitement des complications du COVID-19.
Des preuves récentes indiquent un rôle clé de la protéine suppresseur de ferroptose 1 (FSP1) dans l'inhibition de la ferroptose, en réduisant directement la molécule endogène oxydée coenzyme Q10 (CoQ10) avec NADH comme cofacteur [148]. Il a été rapporté que des lignées cellulaires cancéreuses exprimant de manière stable FSP1 étaient préservées de la ferroptose, y compris de celle causée par les inhibiteurs de GPX4 [148] et une réduction de la CoQ10 a été évaluée comme un RTA lipophile dans la membrane plasmique [149]. Dans ce contexte, il a été montré que l'idébénone, un analogue réduit hydrophile de la CoQ10, pouvait inhiber la ferroptose induite par FIN56, tandis que la supplémentation en CoQ10 s'est avérée inefficace en raison de sa forte hydrophobie [150]. L'idébénone a déjà été évaluée dans plusieurs études précliniques et essais cliniques liés aux maladies mitochondriales et neurologiques, en raison de ses propriétés antioxydantes [134], mais les résultats sont incertains et d'autres études sont nécessaires pour confirmer que l'idébénone est utile dans les dommages organiques provoqués. par ferroptose.