Metabolism of the Branched-Chain Amino Acids are Disrupted by Chemotherapy Drugs
Stephen Mora, fasebj.2021.35.S1.02035
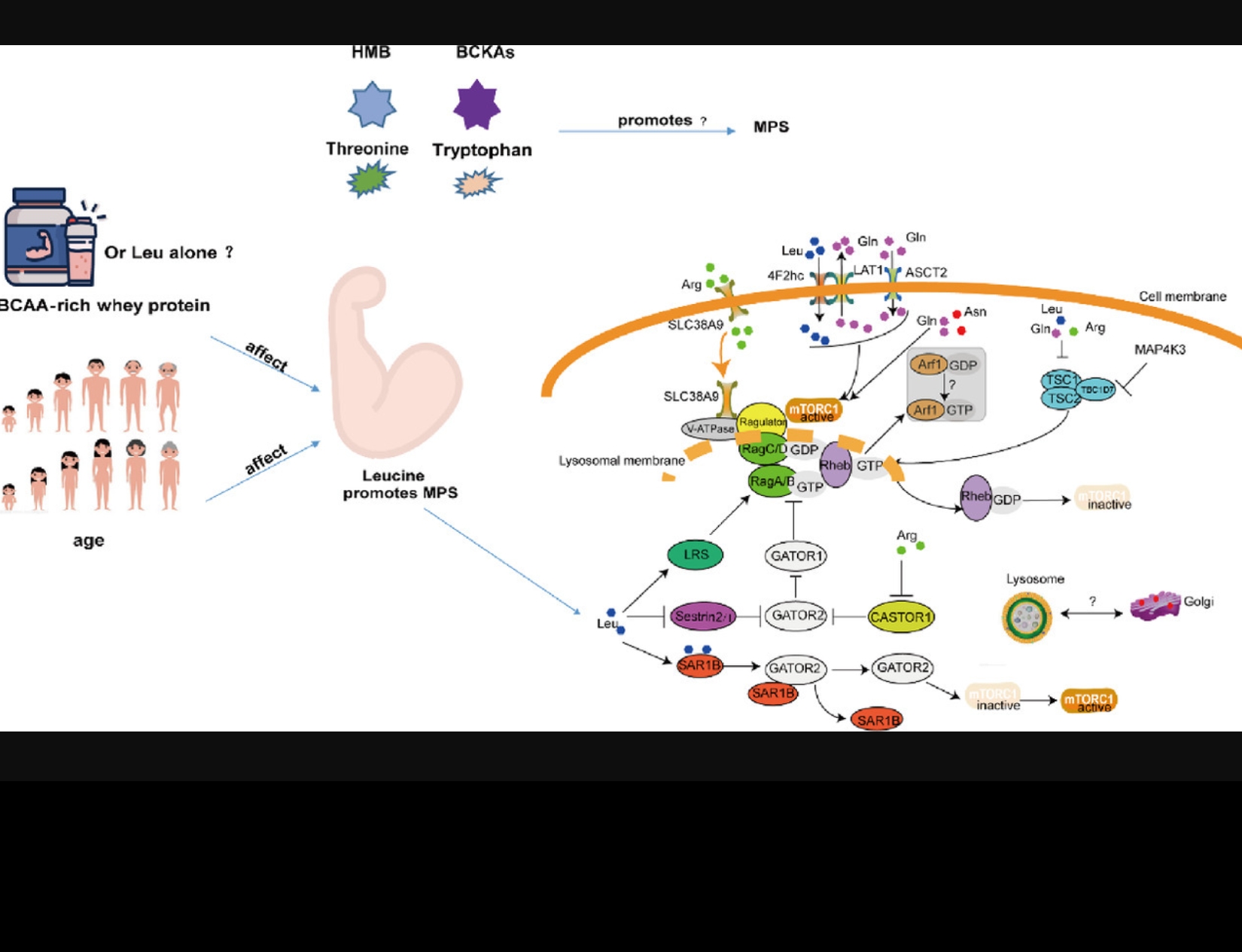
Cachexia is a devastating muscle-wasting condition found in many diseases, including cancer, chronic kidney disease and heart failure. Aside from both tumour burden and disease-related malnutrition, the development of cachexia is associated with chemotherapy treatment. Branched- chain amino acids (BCAA: leucine, isoleucine and valine) are critical regulators of skeletal muscle protein anabolism due to their activation of the mammalian/mechanistic target of rapamycin complex 1 (mTORC1). However, BCAA supplementation/nutritional support does not fully reverse chemotherapy-induced cachexia.
Therefore, we investigated whether breakdown of BCAAs is affected by chemotherapy drugs. On day 4 of differentiation, L6 myotubes were treated with vehicle (1.4μL/mL DMSO) or a common chemotherapy drug cocktail, folfiri (a mixture of CPT-11 (20μg/mL), leucovorin (10μg/mL), and 5-fluorouracil (50μg/mL)) for 24-48h. Myotubes treated with folfiri exhibited ~30% reductions in myotube diameter (p < 0.05, n=3) and ~50% reductions in abundance of myofibrillar proteins myosin heavy chain-1 (MHC) and troponin (p < 0.05). Protein content of branched-chain alpha-ketoacid dehydrogenase complex (BCKD), the enzyme responsible for the irreversible decarboxylation of the BCAA ketoacids, was unchanged following folfiri treatment. However, the activity of this enzyme complex was significantly decreased (~20%) 24 and 48h following treatment with folfiri (p < 0.05). Branched-chain alpha-ketoacid dehydrogenase complex kinase (BDK), a negative regulator of BCKD, was increased 24h (~20%), but unchanged at 48h following folfiri treatment. Compared to vehicle, folfiri-treated myotubes showed a non-significant reduction (~30%) in phenylalanine incorporation into proteins. In line with studies showing a link between impaired BCAA catabolism and insulin resistance, our data suggest a link between chemotherapy-induced muscle atrophy and altered BCAA catabolism.