Traduction de l’étude
 Potentiel d'impact clinique des nutriments supplémentaires en tant que complément du traitement dans le COVID-19 à haut risque pour les patients obèses
Potentiel d'impact clinique des nutriments supplémentaires en tant que complément du traitement dans le COVID-19 à haut risque pour les patients obèses
Front Emre Sahin. Nutr., 22 octobre 2020 |
L'émergence de la maladie du coronavirus 2 (SRAS-CoV-2) du syndrome respiratoire aigu sévère (COVID-19) en Chine à la fin de 2019 a provoqué une pandémie mondiale majeure et continue d'être une crise sanitaire mondiale non résolue. Les interventions de soins de soutien pour réduire la gravité des symptômes ainsi que la participation à des essais cliniques de traitements expérimentaux sont le pilier de la prise en charge du COVID-19 car il n'existe pas de traitement standard efficace pour le COVID-19. La comorbidité du COVID-19 augmente chez les patients obèses. Les micronutriments peuvent renforcer l'immunité de l'hôte contre les infections virales, y compris le COVID-19. Dans cette revue, nous discutons du potentiel d'impact clinique des nutriments supplémentaires en tant que compléments de traitement dans le COVID-19 à haut risque pour les patients obèses.
introduction
La maladie du coronavirus 2 (SRAS-CoV-2) du syndrome respiratoire aigu sévère (COVID-19) a été déclarée pandémie par l'Organisation mondiale de la santé avec plus de 13 378 800 millions de cas confirmés et plus de 580 000 décès dans le monde (1). Les groupes à risque immunodéprimés des populations ont des taux de mortalité élevés en raison de l'immunité insuffisante de l'hôte (2, 3). Le SRAS-CoV-2 endommage les voies respiratoires et provoque des lésions pulmonaires aiguës (ALI) (2, 4, 5). L'ALI déclenche une réponse inflammatoire tout en stimulant le système immunitaire. Cette réponse immunitaire inflammatoire est associée à une tempête de cytokines pouvant entraîner un syndrome de détresse respiratoire aiguë (SDRA) potentiellement mortel caractérisé par une production accrue d'espèces réactives de l'oxygène (ROS) ainsi que de cytokines et chimiokines pro-inflammatoires (6). La tempête de cytokines peut perturber une réponse immunitaire antivirale efficace et provoquer une lymphocytopénie grave ainsi qu'un épuisement des lymphocytes T chez les patients atteints de COVID-19 (7,

.
L'état nutritionnel du corps humain joue un rôle central dans le développement d'une réponse immunitaire efficace et correctement équilibrée aux virus pathogènes (9). Des études récentes ont confirmé l'importance de l'état nutritionnel de l'hôte pour survivre au défi COVID-19 (6, 10, 11). La malnutrition protéino-énergétique (PEM) provoque une réponse immunitaire déséquilibrée aux pathogènes viraux pouvant entraîner une infiltration des poumons par des cellules inflammatoires et le développement d'une pneumopathie suite à une infection virale (12). Les comorbidités des patients atteints de COVID-19 sont corrélées à la gravité de la PEM et contribuent à un risque plus élevé de SDRA et à une augmentation du taux de mortalité des cas (13). Dans COVID-19, la diminution des taux d'albumine sérique (14) et de préalbumine (15) a une valeur pronostique. De faibles taux de préalbumine sérique servent de marqueur de substitution pour la malnutrition et un facteur de mauvais pronostic (16). Nous pensons que l'état nutritionnel de tous les patients atteints de COVID-19 doit être soigneusement évalué et que des programmes de régime alimentaire spéciaux adaptés aux patients garantissent un apport adéquat et équilibré en protéines, calories et micronutriments (17). Un apport quotidien adéquat en protéines, en particulier en lactosérum et en soja, a des effets bénéfiques sur le système de défense antioxydant et l'immunité de l'hôte (18). Parmi les diverses sources de protéines, la protéine de lactosérum a été récemment recommandée comme source d'acides aminés et de protéines bien équilibrée et facile à digérer avec des propriétés anaboliques (19), anti-inflammatoires (20) et immunomodulatrices (21) ainsi que effets antiviraux (22). En plus d'être une partie riche en énergie de l'alimentation quotidienne pour un apport calorique équilibré, les graisses alimentaires, y compris l'huile de poisson et les huiles végétales, fournissent une source d'acides gras essentiels ainsi que de vitamines liposolubles affectant le métabolisme et l'immunité. L'acide alpha-linolénique d'acide gras essentiel (ALA, 18: 3n-3, oméga-3) et les acides gras semi-essentiels acide eicosapentaénoïque (EPA) et acide docosahexaénoïque (DHA) (23, 24) peuvent être utiles pour soutenir la défense immunitaire et le traitement des maladies inflammatoires causées à la fois par des virus et des bactéries (25). De plus, les micronutriments essentiels, notamment les vitamines et les minéraux, jouent un rôle important pour l'intégrité fonctionnelle et la réactivité de notre système immunitaire. Certaines des vitamines (A, pyridoxine, cobalamine, folate, C, D et E) et oligo-éléments tels que Zn, Cu, Se et Fe jouent un rôle crucial dans le maintien et le soutien du système immunitaire (6). Une nutrition équilibrée et un apport en nutriments en quantités et dans une composition appropriées peuvent réduire les niveaux de cytokines pro-inflammatoires et leurs effets secondaires chez les patients atteints de COVID-19 (10).
L'obésité a une prévalence croissante et elle est considérée comme un facteur de risque cliniquement significatif pour les maladies métaboliques ainsi que les infections (26, 27). La consommation d'aliments de «mauvaise qualité» entraîne souvent une carence nutritionnelle chez les personnes obèses malgré les quantités d'aliments consommées plus élevées que la moyenne (25). Une telle carence nutritionnelle peut augmenter la gravité du COVID-19 avec une morbidité et une mortalité accrues (28). Dans cette revue, nous discutons du rôle possible des micronutriments dans la pathophysiologie et les résultats de survie du COVID-19. Nous passons également en revue les connaissances actuelles sur le rôle émergent des nutriments supplémentaires en tant que compléments aux soins de soutien pour COVID-19, en particulier chez les patients obèses.
Micronutriments et patients atteints de COVID-19 souffrant d'obésité
L'insuffisance en micronutriments, notamment la vitamine A, la vitamine D, la vitamine E, la vitamine B1, la vitamine B6, la vitamine B12, la vitamine C, Fe, Zn et Se, appelée «faim latente», entraîne d'importants problèmes de santé dans le monde. Correa-Rodríguez et coll. (89) ont observé des réductions significatives de l'apport en vitamine C, vitamine A et Se chez les jeunes adultes en surpoids ou obèses. Par conséquent, la supplémentation en micronutriments peut soutenir le système de défense naturel du corps en améliorant l'immunité, les barrières épithéliales, l'immunité cellulaire et la production d'anticorps (90).
Vitamines
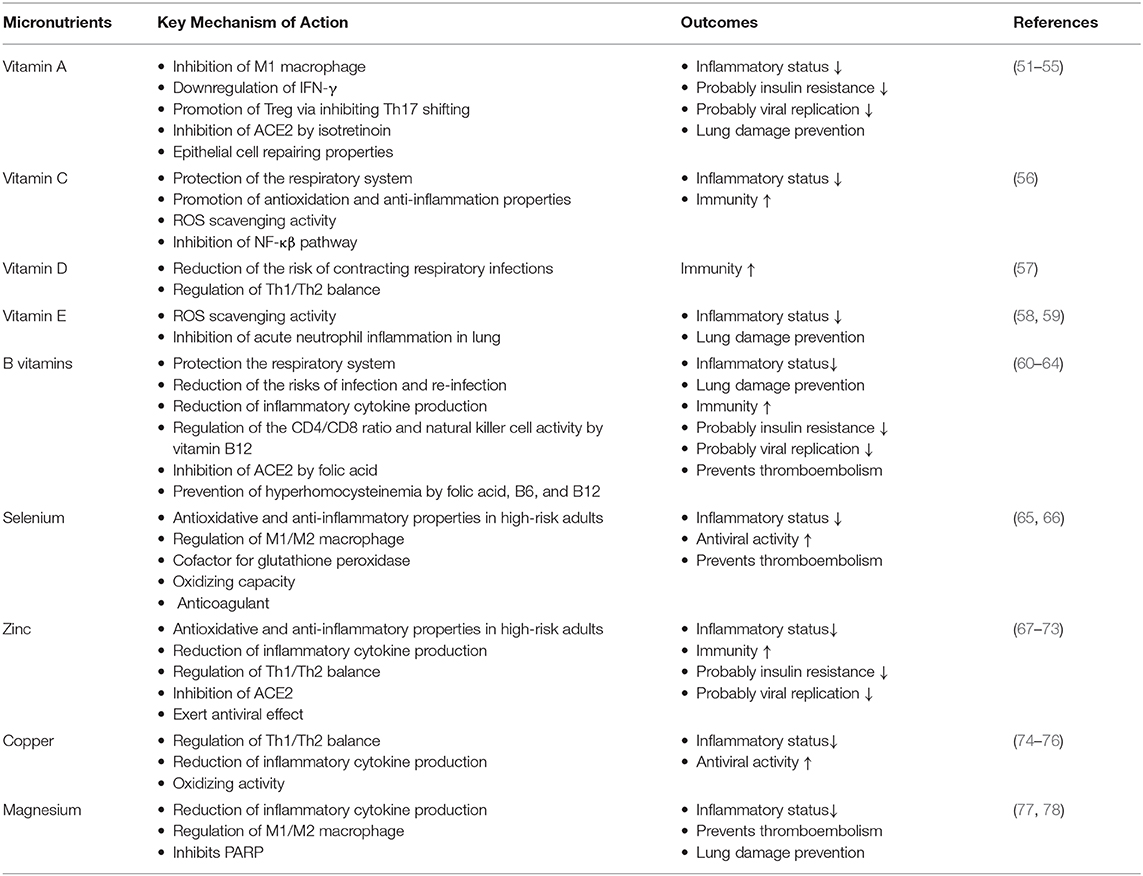
[b]Vitamine A La vitamine A est acceptée comme micronutriment anti-inflammatoire ou anti-infectieux en raison de ses fonctions immunomodulatrices et réparatrices des cellules épithéliales (55). Il a été démontré que la vitamine A réduit la gravité de la pneumonie virale causée par un coronavirus aviaire (91), la rougeole (92), la grippe A, le rotavirus et le virus de la maladie de Newcastle (93). Par conséquent, les rétinoïdes pourraient potentiellement inhiber la réplication du SRAS-CoV-2 et réduire ainsi la gravité du COVID-19 (94). De plus, le dérivé de vitamine A appelé isotrétinoïne (54) peut interférer avec l'absorption cellulaire du SRAS-CoV-2 et sa pathogénicité dirigée vers les poumons en inhibant l'ECA2 (95). L'administration d'acide rétinoïque tout-trans dans un modèle d'hypoxie / réoxygénation a augmenté l'expression de l'ARNm d'ACE2 et a régulé à la baisse l'expression de l'ARNm d'ACE1 et de TGF-β1 dans les cellules épithéliales tubulaires rénales (96). Chez les personnes ayant de faibles taux de vitamine A, des changements histopathologiques ont été détectés dans l'épithélium pulmonaire et le parenchyme pulmonaire, ainsi qu'un risque accru de dysfonctionnement pulmonaire et de maladie respiratoire (97). Des taux sériques normaux de rétinol peuvent masquer la gravité de la carence en vitamine A dans l'obésité (98). La consommation continue du régime occidental réduit les niveaux de vitamine A dans les tissus (99). Une carence en vitamine A et une expression accrue de la leptine augmentent les niveaux de cytokines pro-inflammatoires qui contribuent à l'inflammation systémique de l'obésité (100). Penkert et coll. (98) ont rapporté qu'une supplémentation en vitamine A protège contre une infection virale respiratoire en contrôlant la clairance du virus respiratoire, en diminuant les cytokines inflammatoires dans le sang et en modifiant la capacité immunitaire pulmonaire chez les souris obèses C57BL / 6. De plus, il a été démontré que des doses élevées de supplémentation en vitamine A par voie orale réduisent l'obésité en régulant à la hausse l'expression de la protéine de découplage du tissu adipeux brun (BAT-UCP1) dans le modèle de rat WNIN / Ob (101). Compte tenu des effets du COVID-19 sur la fonction pulmonaire et les propriétés protectrices de la vitamine A dans l'organisme, la vitamine A devrait avoir un effet bénéfique chez les patients obèses COVID-19.
Vitamine C
La vitamine C a été utilisée pour renforcer la défense immunitaire antivirale de l'hôte (56), réduire ou prévenir les symptômes du rhume et d'autres infections respiratoires causées par des virus (102, 103). La vitamine C régule les réponses immunitaires au stade précoce de l'infection grippale en augmentant les niveaux d'interférons de type I (IFN-α et IFN-β) (104) ayant des fonctions critiques pour atténuer la pathogenèse virale (105). La vitamine C est un antioxydant intracellulaire efficace pour les biomolécules et possède une activité de piégeage des ROS significative qui entraîne l'inhibition de la voie de transduction du signal NF-κβ inflammatoire (56). De plus, l'activité phagocytaire des neutrophiles et des macrophages est régulée par leur teneur en vitamine C (106). Un supplément de vitamine C peut diminuer la gravité de l'obésité et ses comorbidités en régulant l'accumulation de lipides, en inhibant la lipolyse qui réduit l'efflux systématique de FFA et la production de glucocorticoïdes, en réduisant l'activité ROS et en interférant avec les macrophages adipocytaires, diminuant ainsi les adipokines pro-inflammatoires (leptine) et les cytokines (107). Dans une méta-analyse de huit essais cliniques randomisés portant sur 3 135 enfants âgés de 3 mois à 18 ans, l'administration de vitamine C a diminué de 1,6 jour la durée de l'infection des voies respiratoires supérieures. Dans la même étude, il a été rapporté que les enfants de 6 ans bénéficient d'une administration plus efficace de vitamine C associée à l'échinacée (108). Dans un essai de phase I randomisé, en double aveugle, contrôlé par placebo, la perfusion d'acide ascorbique a rapidement augmenté la concentration plasmatique d'acide ascorbique et réduit les biomarqueurs pro-inflammatoires des taux de protéine C-réactive (CRP) et de procalcitonine, empêché une augmentation constante des taux de thrombomoduline avec une réduction des lésions vasculaires et une réduction des scores d'évaluation séquentielle des défaillances organiques (109). De plus, un protocole de perfusion retardée d'acide ascorbique et d'acide déhydroascorbique atténue les états pro-inflammatoires et procoagulants qui provoquent des lésions vasculaires pulmonaires et prolongent considérablement la survie (110). Dans l'obésité, un faible statut en vitamine C est en corrélation avec des réactions inflammatoires et un dysfonctionnement vasculaire (111), et une dose de 1 g / jour de traitement à la vitamine C pendant 8 semaines pourrait réduire les taux de CRP et d'IL-6 chez les patients obèses hypertendus et diabétiques (112) .
À des doses plus élevées, la vitamine C peut agir comme un agent oxydant (106). Les propriétés oxydantes de la vitamine C sont renforcées par la présence de fer, augmentant son activité antivirale via la réaction de Fenton qui se traduit par la production de peroxyde d'hydrogène et de radicaux hydroxyles (113). Les différentes doses de supplémentation en vitamine C (125 et 250 mg / kg) ont réduit la signalisation antivirale mitochondriale, le facteur 3 de régulation de l'interféron et l'hydroxylase stéroïdienne chez les souris exposées au stress de contention et à la pneumonie induite par le H1N1 (114). Récemment, Peng (115) a lancé un essai de perfusion de vitamine C randomisé et contrôlé qui vise à atténuer les symptômes respiratoires de l'infection au COVID-19. La vitamine C à forte dose pourrait être un choix efficace dans le traitement précoce du COVID-19 (116). La consommation d'agrumes et de légumes contenant de la vitamine C a été proposée comme une stratégie peu coûteuse pour soutenir le système immunitaire pendant la pandémie de COVID-19 (11).
Vitamine D
Il existe plusieurs variables telles que l'âge, l'indice de masse corporelle, la couleur de la peau et les variantes génétiques qui peuvent affecter les réserves de vitamine D du corps (117). De faibles concentrations sériques de 25-hydroxyvitamine D [25 (OH) D] ont été rapportées chez les humains obèses et une relation inverse entre l'IMC et le 25 (OH) D sérique a été rapportée chez les humains obèses (118). Lin et coll. (119) ont observé une carence en vitamine D [25 (OH) D <20 ng / mL] et une insuffisance [20 <25 (OH) D <30 ng / mL] chez 52 personnes obèses (IMC moyen 37,6 ± 6,4 kg / m2) étaient à 73 et 22% de prévalence. L'expression des enzymes métabolisant la vitamine D (Cyp2r1, Cyp27a1 et Cyp2j3) a été affectée par l'obésité induite par un régime riche en graisses, ce qui peut expliquer en partie les mécanismes du système endocrinien modifié de la vitamine D liés à l'obésité (120). On pense qu'un apport quotidien adéquat en vitamine D freine les infections virales (121, 122). Les infections virales saisonnières affectant les voies respiratoires ainsi que le COVID-19 peuvent être facilitées par une carence en vitamine D (123, 124). Les taux sériques de 25 (OH) D, le métabolite circulant de la vitamine D, sont inversement corrélés à l'inflammation pulmonaire (125) et directement corrélés à la fonction pulmonaire (120) ainsi qu'à la réponse immunitaire de l'hôte (126) lors d'une infection virale respiratoire. La 1,25-dihydroxyvitamine D (1,25D), un métabolite actif de la vitamine D, a des effets pléiotropes sur les éléments du système immunitaire (57, 127-129) et peut réduire la production de cytokines pro-inflammatoires impliquées dans la physiopathologie des ARDS associés au COVID-19 (IFN-γ, TNF-α, IL-1, IL-6, IL-2, IL-12 et IL-17) (Figure 3) (130). L'administration de vitamine D a stimulé la liaison du récepteur d'entrée cellulaire du SRAS-CoV-2 ACE2 au récepteur de l'angiotensine-II de type 1, diminuant le nombre de particules virales qui pourraient se fixer à ACE2 et entrer dans la cellule (131, 132). Par conséquent, une supplémentation en vitamine D pourrait potentiellement réduire l'incidence du COVID-19 sévère (124). Dans des essais contrôlés randomisés portant sur la vitamine D pour la prévention des infections des voies respiratoires (sur 1137 citations extraites, 11 études contrôlées par placebo portant sur 5660 patients), la vitamine D a montré un effet protecteur contre les infections des voies respiratoires, la posologie quotidienne semblant être la stratégie la plus efficace (133). Cela étant dit, une étude clinique menée par Hastie et al. (134) ont indiqué que la relation entre le COVID-19 et les taux sériques de vitamine D n'était pas significative. De plus, la prise de doses élevées de vitamine D peut avoir des effets néfastes sur les patients atteints de COVID-19 (124).
Vitamine E
La supplémentation en vitamine E réduit généralement la gravité des maladies infectieuses, en raison d'effets antioxydants et immunomodulateurs (135). Les tocophérols (α et γ), isomères naturels de la vitamine E, présentent une activité de piégeage des ROS (58) et peuvent bloquer l'inflammation aiguë des neutrophiles dans les poumons (59). Une carence alimentaire en vitamine E peut augmenter la fuite pulmonaire induite par l'IL-1 chez le rat (136) et provoque probablement une lésion pulmonaire hyperoxique aiguë liée à l'inflammation stimulée par l'IL-6 et la 8-iso-prostaglandine F2α chez la souris (137). L'apport oral en vitamine E est positivement associé à la santé pulmonaire (138). Dans un essai clinique randomisé réalisé par Agler et al. (139) ont prouvé qu'une dose de 600 UI de vitamine E (tous les deux jours) réduisait le risque de maladie pulmonaire chronique. Aucune étude n'a été réalisée dans le cas du lien entre la vitamine E et les patients obèses atteints de COVID-19. Meydani et coll. (140) ont constaté qu'un apport quotidien de 200 UI de vitamine E n'a aucun effet sur l'infection des voies respiratoires inférieures. Dans la même étude, l'incidence des infections des voies respiratoires supérieures telles que le rhume est plus faible chez les personnes âgées.
Après l'entrée cellulaire médiée par ACE2, les coronavirus activent d'abord les récepteurs d'hydrocarbure aryle (AhR) sans stimulation par l'indoleamine 2,3-dioxygénase (IDO1) (141). Les AhR activés initient la production de facteurs d'inflammation (IL-1β, IL-6 et TNF-α), induisent une thromboembolie médiée par le facteur tissulaire (TF) et PAI-1 (voie AhR-TF / PAI-1) (142), et conduire une fibrose d'organes multiples via le cytochrome P450, famille 1, sous-famille A, voie de signalisation polypeptide 1 (CYP1A1) / IL-22 avec transducteur de signal et activateur de transcription 3 (STAT3) (143). Les cytokines inflammatoires produites déclenchent l'IDO1 qui métabolise le tryptophane en kynurénine (stimulateur AhR). Par conséquent, ces facteurs de signalisation conduisent à la boucle IDO1-AhR-IDO1 (figure 3) (141). La stimulation de la voie de signalisation AhR module également l'obésité en perturbant le métabolisme des graisses (144). Le degré d'augmentation de l'activation de AhR dépend de la gravité de l'obésité due à une augmentation des facteurs inflammatoires, y compris la médiation par TLR2 / 4- NF-κβ (145). De même, un apport élevé en graisses alimentaires augmente le niveau de LDL sérique (lipoprotéine de basse densité) (146) responsable de l'activation de l'AhR (147). La boucle IDO1-AhR-IDO1 induite par le SRAS-CoV-2 pourrait être exponentiellement augmentée chez les patients obèses COVID-19, et probablement inhibée par la vitamine D pour AhR (148) et la vitamine E pour IDO1 (149). Par conséquent, l'utilisation conjointe des vitamines D et E réduit très probablement les symptômes cliniques de l'infection au COVID-19 et des complications associées à l'obésité.
Vitamines BLa prévention ou le traitement des lésions pulmonaires est essentiel pour le résultat de survie des patients COVID-19. La vitamine B3, un protecteur revendiqué des poumons, peut favoriser la guérison des lésions tissulaires dans les poumons (60, 61), probablement en raison de sa capacité à inhiber la poly ADP ribose polymérase (PARP) (61). Étant donné que l'activité accrue du PARP élève les cytokines inflammatoires qui contribuent à la tempête de cytokines, la thérapie à la vitamine B3 peut réduire la tempête de cytokines dans COVID-19 (6). La forme pyridine-nucléoside de la vitamine B3 appelée nicotinamide riboside fonctionne comme un précurseur du nicotinamide adénine dinucléotide (NAD +), prévient l'ALI / ARDS et les blessures cardiaques, et améliore la survie des souris après la provocation au LPS ou la septicémie causée par l'injection intrapéritonéale de matières fécales ( 150). Chez les rats exposés au LPS, l'administration de nicotinamide a empêché la diminution de la respiration mitochondriale et des taux intracellulaires de NAD + dans les macrophages (151). Dans l'obésité, l'expression de la nicotinamide phosphoribosyltransférase (NAMPT) dans le tissu adipeux diminue et la biosynthèse du NAD + nuit. La réduction des niveaux de NAD + entraîne une diminution de l'adiponectine et une augmentation de la production de FFA (152). La supplémentation alimentaire en précurseurs de NAD + atténue l'inflammation, améliore la sensibilité à l'insuline et réduit le gain de poids corporel dans l'obésité (153).
Les taux de vitamine B6 et la gravité des réactions inflammatoires sont inversement corrélés (154, 155). L'utilisation de la vitamine B6 augmente rapidement dans des conditions inflammatoires et les patients atteints de COVID-19 peuvent probablement avoir une carence en vitamine B6 (156). La vitamine B6 a régulé à la baisse l'inflammation pulmonaire en inhibant l'activation des macrophages, en réduisant la production d'IL-1β, d'IL-6 et de TNF-α dans les macrophages provoqués par le LPS de souris (155). Dans un modèle d'inflammation systémique chez le rat, l'administration orale de 500 mg / kg de riboflavine et 600 mg / kg de thiamine a augmenté l'activité anti-inflammatoire de la dexaméthasone, tout en réduisant la production de TNF-α et d'IL-6 (157). La relation entre la dexaméthasone et la thiamine a causé plus d'inhibition de la production d'IL-6 par rapport à celle induite par la dexaméthasone. La supplémentation en multivitamines dans les 48 h suivant l'hospitalisation, y compris la thiamine, la riboflavine et la niacine, a été associée à une mortalité globale plus faible chez les patients atteints de la maladie à virus Ebola (158).
L'acide folique et ses dérivés tels que l'acide tétrahydrofolique et le 5-méthyl tétrahydrofolate peuvent interférer avec l'entrée cellulaire du SARS-CoV 2 (63) via l'inhibition de la protéine furine qui est essentielle à la progression du COVID-19 (159). En plus de la protéine ACE2, la S-glycoprotéine, certaines des protéases (Mpro et PLpro), l'ARN polymérase ARN dépendante et la Nsp15 favorisent l'entrée cellulaire du SARS-CoV 2 (63, 160). Dans une étude de dépistage virtuelle parmi les 106 nutraceutiques, l'acide folique et les dérivés d'acide folique ont été identifiés comme des agents potentiels qui pourraient avoir un potentiel dans la prophylaxie post-exposition (63).
La carence en certaines vitamines B (acide folique, B6 et B12) et en méthionine, un acide aminé essentiel, entraîne une hyperhomocystéinémie qui conduit à une thromboembolie veineuse (64). Dans l'obésité, le risque cardiovasculaire élevé lié à l'hyperhomocystéinémie est en corrélation avec un état nutritionnel insuffisant du folate et de la vitamine B12. La diminution des taux plasmatiques de folate et de vitamine B12 est acceptée comme un prédicteur de dysfonctionnement vasculaire (161). L'administration d'une dose élevée de vitamine B6 peut réduire les taux de TNF-α, d'IL-6 et de D-dimères et améliorer l'intégrité endothéliale tout en prévenant la coagulopathie chez les patients atteints de COVID-19 (156).
Les minérauxMagnésiumLe magnésium peut soulager les troubles inflammatoires, notamment l'obésité (162) et les infections respiratoires (78). Les macrophages de type M1 produisant du NF-κβ dépendaient du passage de médiateurs pro-inflammatoires vers des macrophages de type M2 après traitement au Mg et stimulaient la sécrétion de cytokines anti-inflammatoires (77). Le faible apport alimentaire en Mg était inversement associé à un dysfonctionnement des cellules endothéliales et à des biomarqueurs de l'inflammation systémique (163). Différentes formes de Mg pourraient être utilisées contre diverses maladies pulmonaires (164). Li et coll. (78) ont rapporté que l'administration de MgSO4 réduisait les taux de PARP-1 et de facteur induisant l'apoptose chez les souris ALI induites par le LPS. Récemment, Tan et al. (165) ont observé que l'administration d'une combinaison orale de vitamine D, Mg et vitamine B12 réduit la détérioration clinique chez les patients atteints de COVID-19. La nutrition au magnésium peut être une stratégie efficace pour le traitement et la prévention de l'infection au COVID-19 (166, 167). De plus, de nombreuses maladies, telles que l'obésité qui causent une carence en Mg (162), exacerbent probablement les symptômes cliniques du COVID-19.
SéléniumLe sélénium est considéré comme un oligo-élément antioxydant important. La gravité et la mortalité des infections virales étaient inversement corrélées aux taux sériques de Se dans plusieurs études (168-170). Les niveaux de virulence et de pathogenèse des virus peuvent être augmentés en raison de l'affaiblissement du système immunitaire après un apport à long terme d'une alimentation insuffisante contenant du Se (171). Les macrophages de type M1 augmentent avec une carence en Se ou un faible apport en Se (65, 172). Cependant, des quantités élevées d'ingestion de Se conduisent à déplacer le phénotype Th2 vers le phénotype Th1 (173). Zhang et coll. (174) ont récemment rapporté que les Chinois à faible teneur en Se capillaire avaient des infections COVID-19 plus graves. La supplémentation en Se peut donc avoir une utilité clinique dans COVID-19 en attendant une confirmation supplémentaire du rôle pronostique de Se pour le résultat de survie des patients COVID-19. Fakhrolmobasheri et coll. (175) ont rapporté que Se pouvait empêcher la mort cellulaire causée par la réplication virale. Chez les patients atteints de SDRA, la supplémentation en sélénite de sodium (1 mg pendant 3 jours et 1 mg / j pendant 6 jours supplémentaires) a reconstitué les niveaux de Se et les concentrations de Se étaient positivement corrélées à l'activité antioxydante. Les concentrations sériques d'IL-1β et d'IL-6 étaient inversement associées aux concentrations sériques de Se. Néanmoins, il n'y avait aucun effet sur la survie globale, le temps de ventilation mécanique et la durée du séjour en soins intensifs (176). Dans les cellules RAW264.7 stressées par le LPS, le LPS a augmenté les profils d'ARNm des gènes inflammatoires, tandis que le prétraitement au Se de courte durée a réduit la régulation positive induite par le LPS de la cyclooxygénase-2, molécule d'adhésion intercellulaire-1, IL-1β, IL-6, IL- 10, oxyde nitrique synthase et monocyte chimioattractant protein-1 et encore augmentation de l'expression de l'IFN-β et du TNF-α (177). Dans la même étude, le LPS a diminué les niveaux d'ARNm des gènes codant pour la sélénoprotéine, tandis que les niveaux d'ARNm des thiorédoxine réductases (TXNRD1 et TXNRD3) dans les cellules ont augmenté. Une carence ou une surexposition en Se altère la synthèse des sélénoprotéines (glutathion peroxydase et TXNRD) qui provoque un dysfonctionnement adipocytaire conduisant à divers troubles métaboliques. L'expression de ces sélénoprotéines est diminuée chez les personnes obèses en raison de leur statut Se inférieur (178). Dans COVID-19, l'expression de la sélénoprotéine peut également être réduite par des facteurs inflammatoires et un statut immunitaire supprimé (179). Par conséquent, une supplémentation alimentaire en Se peut aider à soulager les symptômes cliniques respiratoires et inflammatoires chez les patients obèses souffrant de COVID-19.
ZincLe zinc est un autre oligo-élément important pour améliorer les fonctions immunitaires contre les infections virales (180, 181). Dans les groupes à risque de carence en Zn, y compris le vieillissement, le déficit immunitaire, l'obésité, le diabète et l'athérosclérose, un faible statut en Zn peut être lié à un risque sévère de COVID-19 (182). Le Zn peut exercer son effet antiviral en supprimant la réplication virale, en améliorant la clairance mucociliaire et en augmentant les réponses immunitaires, la prévention des lésions pulmonaires et la régulation de l'immunité antivirale et antibactérienne (73). Le Zn peut fournir un traitement d'appoint peu coûteux et efficace pour certaines maladies virales, y compris les infections respiratoires (183). Par exemple, Mossad et al. (184) ont rapporté que la durée des symptômes du rhume était raccourcie de 7,6 à 4,4 jours avec le gluconate de zinc (contenant 13,3 mg de Zn élémentaire). Des études in vitro ont montré que le Zn présente une activité antivirale en inhibant l'ARN polymérase du SARS-CoV (73). Des données indirectes suggèrent que le Zn peut diminuer l'activité de l'ACE2. L'activité anti-inflammatoire du Zn dépend de l'inhibition de la voie de signalisation NF-κB et de la modulation de la fonction Treg, ce qui peut aider à réduire le risque de tempête de cytokines dans COVID-19 (73). De plus, le Zn s'est révélé vital pour l'épithélium respiratoire, en raison de son activité antioxydante et anti-inflammatoire (185), ainsi que de la régulation des protéines de liaison étroite zonula occludens-1 et Claudin-1, améliorant ainsi les fonctions de barrière (186) . Dans une étude in vitro, il a été démontré que l'administration de Zn (préincubation de 10 μm de Zn) inhibait la réplication du virus respiratoire syncytial par une réduction de plus de 1000 fois (187). L'agent antiviral chloroquine, une ionosphère de Zn utilisée dans le traitement du COVID-19, augmente le transport du Zn dans les cellules (73, 188, 189). Il a récemment été proposé que la gravité de l'infection au COVID-19 puisse être réduite avec un apport quotidien adéquat en Zn (183). Récemment, Finzi (190) a rapporté qu'une supplémentation orale à forte dose de sels de Zn (citrate de zinc, gluconate de zinc ou acétate de zinc) réduisait les symptômes cliniques respiratoires des patients atteints de COVID-19 (190). Conformément à ces informations, il a été suggéré que le Zn pourrait être l'un des micronutriments les plus prometteurs pour la prévention ou le traitement du COVID-19 (191, 192). Les effets du Zn sur l'obésité et les infections virales respiratoires peuvent aider au traitement du COVID-19 chez les patients obèses et en surpoids.
CuivreLe cuivre (Cu), un oligo-élément, joue un rôle important dans l'immunité de l'hôte contre les virus, en régulant les réponses inflammatoires et en renforçant l'immunité de l'hôte dans de nombreuses infections (193–198). L'élévation des taux de Cu dans le tissu pulmonaire a été suggérée comme stratégie pour traiter ou prévenir l'inflammation pulmonaire (199). L'apport alimentaire approprié en Cu dans les limites quotidiennes normales augmente probablement le nombre de cellules phagocytaires, l'activité des cellules Natural Killer, la prolifération des cellules Th (200) et, plus important encore, la production d'IL-2 stimulée par Th1, mais pas de TNF- α (75). Dans ce contexte, Cu peut nécessiter le maintien de l'équilibre du profil Th1 / Th2 (74). L'augmentation de la cytokine pro-inflammatoire TNF-α entraîne une diminution des taux de Cu dans les poumons lors d'infections pulmonaires (199). Raha et coll. (201) ont émis l'hypothèse que la supplémentation en Cu pourrait protéger les populations de patients à haut risque COVID-19 présentant une carence en Cu du développement d'un SDRA.
De plus, l'augmentation de la concentration de ROS peut être utilisée pour présenter l'action antivirale du Cu (76). Les complexes Cu-peroxyde pourraient améliorer l'efficacité de cette action (202). Étant donné les propriétés de production de ROS des surfaces contenant du Cu, les virus SARS-CoV et SARS-CoV-2 sont sensibles aux alliages de Cu (203, 204). Cependant, la supplémentation en Cu peut également augmenter le risque de septicémie et de SDRA et ne doit pas être tentée en dehors d'un essai clinique bien contrôlé.
Autres nutriments importants du COVID-19FlavonoïdesLes flavonoïdes d'origine végétale ayant des activités anti-inflammatoires, antioxydantes et antimicrobiennes (205) ont également un potentiel anti-obésité et anti-diabétique (206). Dans l'obésité et d'autres troubles inflammatoires, les flavonoïdes alimentaires pourraient inhiber la production de cytokines inflammatoires, la sécrétion de leptine, la résistance à l'insuline et améliorer les réponses immunitaires (207). Les polyphénols inhibent le NF-κB et l'activateur de la protéine-1 active le facteur 2 associé au facteur nucléaire érythroïde 2 (Nrf2) et améliore les profils lipidiques en augmentant le cholestérol HDL, tandis que la réduction du cholestérol LDL. Par conséquent, la consommation de régimes riches en polyphénols présente divers effets antioxydants, anti-inflammatoires et réduisant la dyslipidémie (182). Vernarelli et Lambert (208) ont rapporté que la consommation alimentaire de flavonoïdes était inversement corrélée à la gravité de l'obésité et aux taux sériques de CRP. L'inhibition des cytokines inflammatoires par les flavonoïdes (205) dans le contexte d'une infection pulmonaire (209, 210) peut empêcher le développement ou réduire les conséquences négatives de la tempête de cytokines dans COVID-19. De plus, la coagulopathie associée au COVID-19 peut être atténuée par les flavonoïdes grâce à la réduction de la disponibilité du TF endothélial (211). Des études in vitro et in vivo indiquent que les flavonoïdes présentent une activité antivirale contre les virus des voies respiratoires, notamment le SRAS-CoV et la grippe (212). Dans une méta-analyse réalisée par Somerville et al. (213), il a été démontré que les flavonoïdes réduisent potentiellement l'incidence des infections des voies respiratoires supérieures causées par des virus. Des études de criblage informatique virtuel in silico ont démontré que des composés naturels comme les flavonoïdes peuvent inhiber le SARS-CoV-2 en se liant à des protéines S qui ont une affinité pour ACE2 (214). En outre, Adem et al. (215) ont démontré que les flavonoïdes peuvent inhiber le Mpro utilisé par le SARS-CoV-2 pour la réplication virale. En particulier, la quercétine et les catéchines ont une activité antivirale sur le SRAS-CoV (216), et probablement sur le SRAS-CoV 2 (217, 218). De plus, la curcumine (219, 220), l'indométacine et le resvératrol ont été proposés comme suppléments potentiels de soins de soutien contre le COVID-19 (221).
LactoferrineLa lactoferrine, qui présente une activité antimicrobienne, a des activités anti-inflammatoires et immunomodulatrices (222). En raison de son activité antivirale, de nombreux virus, y compris le SRAS-CoV (223), pourraient être tués par la lactoferrine (224-226). L'action antivirale signalée de la lactoferrine contre le SRAS et le COVID-19 découle très probablement du blocage de l'activité de l'ACE2 et du protéoglycane de sulfate d'héparane, qui sont nécessaires pour l'entrée cellulaire du SRAS-CoV et du SRAS-CoV 2 (227). De plus, une étude clinique réalisée par Serrano et al. (228) ont indiqué que la lactoferrine liposomale bovine associée à la vitamine C et au Zn atténuait les symptômes de l'infection au COVID-19. De même, la lactoferrine peut soulager l'obésité en inhibant la production de leptine et en contrôlant la libération de LPS par le microbiote intestinal (229). Dans ce contexte, les fonctions de réduction de la leptine du Zn et de la vitamine C (230) associées à la lactoferrine peuvent être bénéfiques dans le traitement du COVID-19 chez les personnes obèses.
Acides gras essentiels Les acides gras polyinsaturés alimentaires (AGPI) et leurs métabolites exercent des effets protecteurs efficaces pendant l'inflammation systémique (231). La supplémentation en AGPI n-3 réduit l'inflammation systémique des patients obèses non diabétiques (232). L'EPA et le DHA peuvent inhiber les voies de signalisation inflammatoires NF-κB et TLR (233). Ces acides gras à longue chaîne diminuent également le rapport des macrophages M1 / M2 dans les tissus adipeux, réduisant ainsi l'état inflammatoire et diminuant la résistance à l'insuline (234). Les AGPI oméga-3 et ses dérivés lipidiques tels que les résolvines et les protectines (protectine D1), lorsqu'ils sont utilisés à des doses appropriées et selon des schémas d'administration rationnels, pourraient être potentiellement utiles pour réduire la production de cytokines pro-inflammatoires qui conduit à une tempête de cytokines dans COVID-19 (235). Surtout, il a été démontré que les AGPI oméga-3 et oméga-6 réduisent l'agrégation plaquettaire et peuvent donc prévenir la thrombose (236) et réduire le risque de complications thromboemboliques chez les patients atteints de COVID-19 qui ont été associés à un mauvais résultat de survie (237).