Traduction de l'étude
 Micronutriments et composés bioactifs dans les voies immunologiques liées au SRAS-CoV-2 (adultes et personnes âgées) Juliana Arruda de Souza Monnerat, European Journal of Nutrition volume 60, pages 559-579 (2021)
Micronutriments et composés bioactifs dans les voies immunologiques liées au SRAS-CoV-2 (adultes et personnes âgées) Juliana Arruda de Souza Monnerat, European Journal of Nutrition volume 60, pages 559-579 (2021) La nouvelle pandémie de coronavirus affecte le monde entier avec plus de 25 millions de cas confirmés en août 2020 selon l'Organisation mondiale de la santé. On sait que le virus peut affecter plusieurs tissus et évoluer vers une insuffisance respiratoire dans les cas graves. Pour empêcher la progression vers ce stade de la maladie et minimiser tous les dommages causés par le coronavirus (SRAS-CoV-2), le système immunitaire doit être dans son intégrité. Un état nutritionnel sain est fondamental pour une protection immunologique efficace et par conséquent une bonne réponse au SRAS-CoV-2. Les micronutriments et les composés bioactifs remplissent des fonctions dans les cellules immunitaires qui sont extrêmement essentielles pour arrêter le SRAS-CoV-2. Leur consommation adéquate fait partie d'une intervention non pharmacologique pour maintenir le système immunitaire en état de fonctionnement. Cette revue a pour objectif principal d'éclairer comment les micronutriments et les composés bioactifs pourraient agir dans les voies immunologiques essentielles pour arrêter le SRAS-CoV-2, en se concentrant sur les fonctions déjà établies dans la littérature et en se transposant à ce scénario. introduction Le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2), la nouvelle pandémie de coronavirus, désignée par l'Organisation mondiale de la santé (OMS) comme maladie à coronavirus 2019 (COVID-19) a atteint presque tous les pays ou territoires du monde, avec plus de 25 millions de cas confirmés et plus de 800 000 décès selon les données publiées sur le site Internet de l'OMS au 31 août 2020 [1].
Le SRAS-CoV-2 est un virus enveloppé, non segmenté, avec un simple brin d'ARN, une bicouche phospholipidique recouverte de glycoprotéines «spike», et sa pathogenèse étant étudiée par plusieurs chercheurs [2]. La figure 1 représente un schéma des principaux composants structurels du virus. Bien que les mécanismes physiopathologiques associés au COVID 19 ne soient pas complètement élucidés, Guan WJ et ses collègues ont montré que toutes les personnes exposées au SRAS-Cov-2 ne seront pas infectées et que toutes les personnes infectées ne développeront pas les symptômes les plus graves [3]. Sur cette base, le sujet infecté peut être classé en trois stades distincts, selon les symptômes et la présence du virus [4]. Le stade 1 est lié à la période d'incubation du virus, qui peut être détectée ou non, et à l'absence de symptômes du COVID-19 également. Le stade 2 est la période pendant laquelle le virus peut être détecté et où les symptômes sont légers. Enfin, le stade 3 représente la période pendant laquelle le sujet a une charge virale élevée et des symptômes respiratoires sévères [4]. Outre le système respiratoire, une altération fonctionnelle induite par le SRAS-CoV-2 a été observée dans les systèmes nerveux, cardiovasculaire et gastro-intestinal [5, 6]. Une fois que l'intégrité du système immunitaire humain (SI) a un rôle central pour protéger le corps contre la gravité des symptômes dans les différents systèmes, la réponse immunitaire (IR) appropriée est extrêmement nécessaire pour contrôler ou minimiser les effets de l'infection virale [2].
Un état nutritionnel sain est fondamental pour une protection immunologique efficace. Pour assurer la fonctionnalité du SI, la contribution idéale des macro et micronutriments doit être prise en compte [7, 8]. Il a déjà été bien établi que lors de l'augmentation de la demande énergétique induite par l'infection, un apport adéquat en glucides, protéines et lipides est essentiel pour l'activation de l'IS [7]. D'autre part, le statut de malnutrition est associé à l'engagement RI [7]. En plus des macronutriments, les micronutriments ont également un rôle important dans le SI. Même ainsi, sur la base du régime alimentaire, presque tous les sujets ont probablement un apport insuffisant en micronutriments, ce qui peut altérer les performances de l'IS [7]. Il est important de souligner que les micronutriments agissent en synergie, c'est-à-dire que le corps humain a besoin d'une concentration adéquate de tous les micronutriments impliqués dans l'IR pour garantir la barrière immunitaire des cellules [8].
D'autres substances présentes dans une alimentation saine, comme certains composés bioactifs, notamment les polyphénols, jouent également un rôle important dans le SI, en raison de leurs propriétés antioxydantes et anti-inflammatoires [8]. Ils agissent en régulant les cellules immunitaires, l'expression des gènes et en inhibant certaines cytokines pro-inflammatoires [9]. Ainsi, les micronutriments et les composés bioactifs pourraient contribuer au traitement adjuvant des patients déjà infectés par le SRAS-CoV-2, car il cible des cellules IS spécifiques, telles que les macrophages, les cellules NK et les cellules T [2] qui pourraient avoir des réponses potentialisé par certains nutriments et composés bioactifs. Cette intervention non pharmacologique pourrait aider à diminuer la gravité des symptômes en modulant le SI de l'hôte. Il est important de noter qu'à l'heure actuelle, il n'y a pas d'informations solides dans la littérature scientifique montrant comment un état nutritionnel adéquat ou une consommation alimentaire spécifique pourrait aider à réduire la propagation du SRAS-CoV-2 et à contrôler la progression du scénario pandémique actuel du COVID-19. . Cependant, il existe des preuves pertinentes publiées récemment montrant le rôle de certains micronutriments dans la réduction du risque de COVID-19 et d'autres infections virales (par exemple, la grippe), comme la vitamine D [10,11,12,13], la vitamine A, le sélénium, le zinc [14, 15], cuivre [16] et vitamine C [17, 18]. Une revue systématique sur les interventions potentielles pour COVID-19 suggère l'importance de l'évaluation individuelle de l'état nutritionnel avant l'administration de tout traitement proposé [19], mettant en évidence le rôle synergique des nutriments dans l'IR. En outre, éviter les carences nutritionnelles en utilisant des stratégies nutritionnelles efficaces et sûres peut aider à réduire le nombre de personnes infectées [20]. Par conséquent, cette revue a pour objectif principal d'informer comment les micronutriments et les composés bioactifs pourraient agir dans les voies immunologiques essentielles pourraient arrêter le SRAS-CoV-2, en se concentrant sur les fonctions déjà établies dans la littérature et en les transposant à ce scénario
Stratégie de recherche La stratégie de recherche comprenait PubMed en utilisant les principaux mots-clés liés aux réponses immunologiques, au COVID-19, aux micronutriments et aux composés bioactifs (par exemple, système immunitaire, SRAS-CoV-2, vitamines, minéraux, polyphénols). Des livres et un tableau sur la composition des aliments ont complété les informations sur les sources alimentaires, la quantité et la biodisponibilité des micronutriments et des composés bioactifs. Cette revue comprenait les preuves de COVID-19 publiées dans les années 2019 et 2020. Comprend également des articles sur les micronutriments, les composés bioactifs et les réponses immunitaires publiés entre les années 1990 et 2020. Anglais ou portugais. Aucune évaluation systématique ni analyse statistique n'a été effectuée. Réponses immunologiques et Covid-19 Après l'invasion de l'hôte viral, la première reconnaissance se fait par l'intermédiaire du SI inné via des récepteurs de reconnaissance de formes (PRR), tels que les récepteurs de type I-like inductibles par l'acide rétinoïque [rig-I-like receptor (RLR)], qui sont responsables pour reconnaître le matériel génétique viral [2, 21]. La cascade d'inflammation commence par la liaison du SRAS-CoV-2 aux macrophages qui présentent par conséquent ses antigènes pour les cellules TCD4, générant leur activation et également leur différenciation en cellules T helper de type 17 (Th17), par exemple. Ensuite, des cytokines sont produites pour mobiliser l'ensemble de l'IR adaptatif. Il s'agit des interleukines (IL) 1, 6, 8 et 21, du facteur de nécrose tumorale β (TNF-β) et de la protéine chimioattractive monocytaire 1 (MCP-1). Ces médiateurs stimulent les cellules T pour activer les cellules tueuses naturelles (NK) et les cellules TCD8 [2]. Les cellules TCD4 sont responsables de la production d'anticorps spécifiques contre le SRAS-CoV-2 par l'activation des cellules B. Les cellules TCD8 sont importantes pour le contrôle viral, car elles sont cytotoxiques, jouant un rôle crucial dans l'élimination du SRAS-CoV-2 des cellules infectées, et sont associées à une induction immunologique [2, 22]. Pour atteindre le cytoplasme de la cellule, le SARS-CoV-2 se lie à un récepteur spécifique, appelé dipeptidyl peptidase-4 (DPP4), via sa glycoprotéine de pointe (S), favorisant l'adhésion entre la protéine et le récepteur. Pour que la présentation du génome viral se produise, la protéine S doit se lier au récepteur de type outil (TLR) -4. La reconnaissance de la protéine S déclenche la production de cytokines pro-inflammatoires via une voie de signalisation dépendant de la protéine de réponse primaire au facteur de différenciation myéloïde-88 (MyD88). Ensuite, on observe l'activation du facteur nucléaire kappa B (NF-kB), la production d'IL-1 et d'IL-6, en plus de l'interféron de type 1 (IFN-1) et du TNF-β [2]. Une autre voie pourrait être stimulée par la liaison de l'ARN viral au récepteur TLR-3, ce qui induit l'activation des voies inflammatoires à travers les facteurs de régulation de l'interféron (IRF). Par conséquent, il culmine également dans la production d'IFN-1, d'IL-1, d'IL-6 et de TNF-ß. Si l'ARN viral se lie au TLR-7 et / ou au TLR-9, on observe également l'activation de NF-kB et d'IRF. La présence de ces cytokines attire les lymphocytes et les leucocytes vers la cellule infectée jusqu'à ce que l'infection puisse être contrôlée [2]. Il est important de souligner le rôle de l'IFN-1 dans le contrôle de la propagation virale. IFN-1 active les cellules dendritiques et NK, en plus d'accélérer la phagocytose par les macrophages d'antigènes viraux [2, 21]. La figure 2 illustre le processus d'activation immunitaire. S'il y a une altération de la barrière immunitaire et que la propagation du virus ne peut être contenue, le SRAS-CoV-2 prolifère et affecte principalement les tissus qui ont une forte expression de l'enzyme de conversion de l'angiotensine 2 (ACE 2), comme les reins, l'intestin , poumons, cerveau et système cardiovasculaire [23, 24]. L'affinité du virus pour l'ECA 2 peut être une explication pour les patients décédés d'une défaillance multiviscérale [23]. Récemment, Cheng H et ses collègues [25] ont montré que le virus dépendait de l'expression de l'ACE 2 dans l'épithélium respiratoire pour pouvoir pénétrer et démarrer sa réplication. Ensuite, les cellules endommagées génèrent la cascade inflammatoire décrite ci-dessus, commençant par la présentation du virus aux lymphocytes et se terminant par la libération de cytokines pro-inflammatoires. Les macrophages pro-inflammatoires et les IR médiés par les granulocytes aboutissent à des troubles respiratoires, principal symptôme du stade le plus sévère du COVID-19 [24, 26]. Les cytokines pro-inflammatoires telles que l'IL-1, l'IL-6 et le TNF se trouvent à des concentrations élevées dans les poumons du patient infecté et pourraient être un déclencheur possible de la formation de mucus pulmonaire et d'induction de fibroblastes [23]. Ainsi, les stratégies qui permettent de bloquer ou de réduire les actions de ces cytokines pro-inflammatoires peuvent bénéficier aux patients à des stades plus avancés de COVID-19 [24].
Micronutriments Une fois que les connaissances scientifiques sur les mécanismes et processus impliqués dans l'activation et la production des cellules et des cytokines liées aux réponses immunitaires du SRAS-CoV-2 ont été présentées précédemment, il est important de comprendre comment certains micronutriments pourraient être fondamentaux pour l'homéostasie du SI pendant le SRAS-CoV -2 infection. Certains micronutriments sont liés à l'inhibition, à la stimulation ou au rôle de cofacteur des cellules et des cytokines altérées par ce virus. Par conséquent, cette section rassemble les principales vitamines et minéraux qui contribuent à la fonction IS.
Vitamine A Certaines revues scientifiques antérieures ont souligné l'importance de la vitamine A pour le bon fonctionnement des cellules IS innées, comme les cellules NK et les macrophages [8, 27]. En outre, la vitamine A est fondamentale pour les performances des cellules T et B et le mécanisme de production d'anticorps en réponse à l'antigène spécifique [28, 29]. Preuves in vivo Sa carence est associée à la réduction du nombre et de la fonctionnalité des cellules NK et à l'augmentation de l'INF γ, et intervient négativement dans les activités phagocytaires et macrophages ainsi que dans les études expérimentales sur les rongeurs [30]. De plus, des niveaux insuffisants de vitamine A pourraient affecter la différenciation et quantité de cellules T, ce qui réduit la génération d’anticorps et par conséquent diminue la réponse au virus chez les rongeurs [31, 32]. Preuves in vitro Un statut déficient en vitamine A affecte négativement la différenciation de la croissance des cellules B [33].
Vitamine B6 Tout comme la vitamine A, la vitamine B6 participe à la production d'anticorps et à l'activité des cellules NK [27, 28, 34]. Il est nécessaire pour les cytokines et les acides aminés endogènes la synthèse et le métabolisme [29]. Preuves in vivo La vitamine B6 contribue également à la régulation de l'inflammation, au maintien des réponses Th 1 et au processus de prolifération, de différenciation et de maturation des lymphocytes dans des études expérimentales chez les rongeurs [35, 36]. En outre, des niveaux plus élevés de forme active B6 diminuent l'inflammation chez l'homme [37]. Son déficit peut entraîner une lymphocytopénie et une déficience immunitaire qui en résulte, diminuant également les réponses médiées par les anticorps [38].
Vitamine B7 La biotine (vitamine B7 ou vitamine H) est un cofacteur essentiel de cinq carboxylases, appelées carboxylases dépendant de la biotine, impliquée dans le métabolisme de plusieurs voies telles que la gluconéogenèse, le métabolisme des acides aminés à chaîne ramifiée et la synthèse des acides gras [39, 40] . Les troubles métaboliques peuvent entraîner des modifications des réponses IS et des processus inflammatoires causés par une carence en biotine [39].
Preuves in vitro Des recherches antérieures montrent que la carence en biotine peut affecter les réponses immunitaires, en augmentant les lymphocytes T CD4 dans les échantillons sanguins humains [41]. Par conséquent, conduisant à une augmentation du niveau d'IFN-γ, TNF et IL-17 et à une augmentation des réponses pro-inflammatoires [41]. En outre, les cellules dendritiques conduisent à des réponses Th1 et Th17 par une production accrue de cytokines pro-inflammatoires lorsque les niveaux de biotine sont insuffisants [42].
Vitamine B9 La vitamine B9 ou folate est impliquée dans le maintien de la cytotoxicité des cellules NK et la production et le métabolisme des anticorps, permettant une réponse antigénique suffisante à l'antigène [26, 27, 29]. Preuves in vivo Des études animales et humaines montrent une association de carence en folates avec une réponse immunitaire dépressive, altérant, par exemple, la prolifération des cellules T [38]. Dans le modèle de rongeur, les réponses anticorps peuvent être inappropriées dans cette situation [29].
Vitamine B12 La vitamine B12 étant un cofacteur du métabolisme des folates, elle contribue indirectement à la production et au métabolisme des anticorps [28, 29, 34]. Preuves in vivo Immunomodulateur important, la vitamine B12 est associée aux cellules cytotoxiques, comme NK et TCD8, facilitant sa production et aidant à réguler la proportion entre les cellules T auxiliaires et cytotoxiques chez l'homme [43, 44].
Vitamine C La vitamine C est largement connue pour ses propriétés antioxydantes et immunomodulatrices, capables de protéger les lymphocytes du stress oxydatif [29]. Il est fondamental pour la régénération d'autres composés antioxydants, comme le glutathion et la vitamine E, permettant la conversion en leur forme active [45]. Preuves in vivo La carence en vitamine C est liée à une augmentation des dommages oxydatifs cellulaires et à l'incidence et à la gravité des cas de pneumonie chez l'homme [46, 47]. La vitamine C est également impliquée dans le maintien et l'amélioration de l'activité des cellules NK et de leur chimiotaxie [27, 28, 48, 49], l'élimination et l'apoptose des neutrophiles médiée par les macrophages chez les rongeurs et les humains [50]. En outre, il peut stimuler la production, la fonction et le mouvement des leucocytes vers le site d'infection [29, 47]. Preuves in vitro Enfin, la vitamine C joue un rôle dans la production, la différenciation et la prolifération des lymphocytes T, entraînant la production de lymphocytes T cytotoxiques et l'augmentation de la génération d'anticorps [29, 48, 50].
Vitamine D La vitamine D est l'un des micronutriments les plus étudiés impliqués dans la fonction SI. Les récepteurs de la vitamine D peuvent être trouvés dans les cellules IS innées telles que les macrophages, les monocytes et les cellules dendritiques [29].
Preuves in vitro Cette vitamine est capable d'augmenter la différenciation des monocytes en macrophages [48] et sous sa forme active (c'est-à-dire le calcitriol), elle est associée pour favoriser le mouvement des macrophages et la capacité phagocytaire, améliorant leur potentiel oxydatif [28, 51,52,53] . De plus, la vitamine D stimule la prolifération des cellules immunitaires, augmente la synthèse du superoxyde et aide à se protéger contre les infections causées par des agents pathogènes [29]. Concernant le SI adaptatif, la vitamine D peut induire une suppression de la production d'anticorps des lymphocytes B et de la prolifération des lymphocytes T [29]. Preuves in vivo De plus, la vitamine D est liée à l'inhibition des fonctions cytotoxiques et auxiliaires des cellules T et à la promotion de la production de cellules T régulatrices T [49, 54, 55]. Il peut réduire l'expression des cytokines pro-inflammatoires et augmenter les cytokines anti-inflammatoires in vitro et in vivo des modèles expérimentaux [29, 51, 56,57,58,59,60]. Sa carence augmente la sensibilité et la gravité aux infections, en particulier les infections aiguës des voies respiratoires, diminue le nombre de lymphocytes et augmente la morbidité et la mortalité chez les enfants [46, 61].
Vitamine E Outre le profil anti-inflammatoire, la vitamine E est un composé antioxydant important, protégeant les cellules contre les radicaux libres [29, 48]. Preuves in vivo Parmi ses fonctions anti-inflammatoires, la vitamine E améliore l'activité des cellules NK, la prolifération des lymphocytes et les fonctions médiées par les cellules T, aidant à construire des synapses immunitaires entre les cellules T auxiliaires. Indirectement, la vitamine E protège les fonctions des lymphocytes T en diminuant la production de prostaglandine E2 (PGE2) par les macrophages, qui a une activité immunosuppressive dans plusieurs études sur des modèles animaux et humains [27, 28, 48, 49, 62, 63]. Son déficit peut altérer l'immunité adaptative, affectant les fonctions des lymphocytes T et B [29].
Le cuivre Le cuivre est un minéral qui s'accumule sur le site de l'inflammation [29, 34]. Tout comme le zinc, le cuivre est directement lié à l'enzyme superoxyde dismutase (SOD), importante dans la défense contre les espèces réactives de l'oxygène (ROS) [28]. Ainsi, il est considéré comme un piégeur de radicaux libres, capable de maintenir un équilibre antioxydant intracellulaire [28, 64]. Preuves in vivo Pour réagir contre les agents infectieux, le cuivre agit sur les macrophages, s’accumule dans leurs phagolysosomes et améliore l’activité NK chez le rat [65, 66]. De plus, il participe à la différenciation et à la prolifération des cellules T, à la production d'anticorps et à l'immunité cellulaire dans les études animales [34, 35]. Sa carence peut entraîner une diminution anormale des neutrophiles et augmenter la sensibilité aux infections chez l'homme [29, 67, 68].
Le fer Le fer est impliqué dans la production et l'action des cytokines inflammatoires telles que l'IFN-γ, le TNF-α, l'IL-2 et l'IL-10 [48], et il est également important de générer des ROS qui tue le pathogène qui infecte IS [29] ]. Preuves in vitro En relation avec le SI adaptatif, le fer est impliqué dans la différenciation et la prolifération des cellules T et aide à réguler la proportion entre les cellules T auxiliaires et les cellules T cytotoxiques [29, 49]. Preuves in vivo Un niveau de fer plasmatique adéquat est capable de moduler l'IS, réduisant la réponse pro-inflammatoire du macrophage M1 chez la souris [69, 70]. Sa carence peut réduire la réponse immunitaire chez l'homme [38, 70]
Magnésium Preuves in vivo Chez l'homme, le magnésium est associé à la protection de l'ADN contre les dommages oxydatifs [71]. Preuves in vitro À des concentrations élevées, le magnésium réduit la production d'anions superoxyde [72]. Il est fondamental de lier les antigènes à l'ARN des macrophages, de réguler l'activation des leucocytes, c'est un cofacteur de la synthèse des anticorps et est impliqué dans la régulation de l'apoptose [65, 66].
Sélénium Ce minéral est essentiel à l'activité des sélénoprotéines, ce qui est important pour la défense antioxydante de l'hôte [19]. Preuves in vivo Les sélénoprotéines peuvent affecter les fonctions des cellules NK et des leucocytes et potentiellement réduire la production exagérée de ROS pendant le stress oxydatif [27, 29, 34, 48, 73]. Le sélénium participe également à la différenciation et à la prolifération des lymphocytes T, améliore le nombre de lymphocytes T auxiliaires et les niveaux d'anticorps [34, 64, 74]. Son déficit peut altérer l'immunité cellulaire et humorale, en plus d'augmenter la virulence lors d'infections virales chez l'homme et le rat [29, 46, 74, 75].
ZincLe zinc est un agent antioxydant important contre les ROS et les espèces azotées réactives (RNS) [45, 47]. Preuves in vitro Le zinc est essentiel pour que la tyrosine kinase intracellulaire se lie aux récepteurs des cellules T, favorisant le développement et l'activation des lymphocytes T [45, 47]. En outre, le zinc induit la prolifération des cellules cytotoxiques T et est impliqué dans le développement des cellules T régulatrices (Treg) [49, 76,77,78]. Preuves in vivo Ce minéral est également un agent anti-inflammatoire, capable de moduler la libération de cytokines grâce à la régulation du développement de cellules pro-inflammatoires, telles que Th17 et Th19, et de la production de cytokines, telles que IL-2, IL-6, et TNF-α dans plusieurs études sur l'homme et l'animal, en plus des preuves in vitro [49, 76,77,78,79,80,81]. Il contribue au maintien et à l'amélioration de l'activité cytotoxique des cellules NK, de la capacité phagocytaire des monocytes, il aide à la prolifération des cellules TCD8 et il influence l'activité des protéines antioxydantes [27,28,29, 47,48,49, 78, 82, 83]. Le zinc est également impliqué dans la production d'anticorps, principalement l'immunoglobuline G (IgG), et dans sa réponse dans des modèles animaux [28, 78, 84, 85]. Enfin, des niveaux adéquats de zinc sont importants pour maintenir la défense immunologique de l'hôte [49]. Sa carence est associée à une altération de l'IS total, affectant le nombre et la fonction des lymphocytes, en particulier des cellules T, et conduit à une altération de la production de cytokines qui contribuent au stress oxydatif et à l'inflammation [29]. Elle peut être associée à une augmentation des infections virales (en particulier la pneumonie) et respiratoires chez l'homme [38, 46]. Pour que tous les micronutriments remplissent leurs fonctions, il faut porter une attention particulière à son apport en fonction de l'apport alimentaire quotidien recommandé (AJR) pour les individus en bonne santé, qui tient compte de la tranche d'âge de chaque individu. Le tableau 1 fournit ces informations pour les adultes, en plus de compiler les principales fonctions du SI et les sources alimentaires de chaque micronutriment. Il convient de mentionner que les valeurs quotidiennes de ces micronutriments pourraient être modifiées, avec la nécessité de plus grandes quantités de ces composés pour fournir un soutien immunitaire idéal [8]. De plus, il est fréquent d'un apport quotidien insuffisant en vitamines et minéraux, même lorsque l'accessibilité aux aliments est aisée.
Dans ce cas, une supplémentation peut être nécessaire pour améliorer les réponses immunitaires spécifiques [8]. Cependant, lorsque cette supplémentation est à très fortes doses, elle peut avoir des conséquences défavorables sur le métabolisme (par exemple, hypervitaminose) et IS, mettant en évidence un risque plus élevé pour la vitamine A, le fer et le cuivre [29, 34]. À titre d'exemple, dans une petite étude chez l'homme, un apport élevé en cuivre pendant une longue période a pu réduire la production d'anticorps contre un vaccin antigrippal [86]. Si une supplémentation est nécessaire, il est important de respecter les limites de sécurité préalablement établies par l'Institute of Medicine (IOM) [8, 87]. En outre, il est essentiel de consulter des études de haute qualité précédemment publiées avec un plan expérimental cohérent [8].
Composés bioactifs Les composés bioactifs sont des composés essentiels et non essentiels, largement présents dans les fruits et légumes [88]. Ils sont responsables des couleurs, des arômes et sont liés à des activités pharmacologiques potentielles sur la santé humaine [88, 89]. Ces composés ont de nombreuses classifications, telles que les polyphénols, les phytostérols, les terpénoïdes, les composés organosulfurés et les alcaloïdes [90]. De nombreux polyphénols ont un impact important sur l'EI via la modulation des cellules immunitaires, la production de cytokines et l'expression de gènes pro-inflammatoires [91, 92]. Cette section présentera les principales cellules immunitaires et les voies qui sont positivement liées aux composés bioactifs. Inflammation et stress oxydatif Certains polyphénols sont connus pour leur potentiel anti-inflammatoire. Selon des études in vivo et dans des cellules humaines, le resvératrol peut inhiber les cytokines pro-inflammatoires, telles que le TNF-α et l'IL-6, tandis que la curcumine contribue à réduire le TNF et l'IL-1. La curcumine induit également une réduction de l'activation de NF-kB et de l'expression des TLR 2 et 4 [93,94,95,96,97,98,99]. Dans les conceptions expérimentales utilisant des cellules humaines, le gallate d'épigallocatéchine (EGCG) et le gingérol, présents respectivement dans le thé vert et le gingembre, sont d'autres polyphénols qui contribuent à la fonction NF-kb [95, 100, 101, 102]. L'apport en polyphénols est directement associé à la numération et à la différenciation des cellules IS. Certaines études in vitro, sur des modèles expérimentaux de rongeurs et chez l'homme, ont observé des altérations des cellules NK, des macrophages, des cellules dendritiques, du nombre de cellules Th1 et TCD4 [91, 103, 104, 105]. D'autres types de T auxiliaire peuvent être modulés, tels que Th9 et Th17, par EGCG également [106]. Plusieurs études in vivo et in vitro montrent les propriétés anti-inflammatoires des polyphénols qui induisent l’élimination des radicaux libres, la chélation des ions métalliques et l’inhibition de la NADPH oxydase. Les polyphénols contribuent à la chaîne respiratoire mitochondriale, ils induisent également une réduction de la production exagérée de ROS, en inhibant certaines enzymes impliquées et en régulant positivement les enzymes antioxydantes [9]. Concernant les métaux, la curcumine peut jouer un rôle dans la chélation des métaux de transition, comme Cu2 + et Fe2 +, tandis que la quercétine et l'ECGC chélatent Fe2 + en culture cellulaire à l'aide de monocytes THP1 [107]. Le resvératrol et la curcumine sont les polyphénols qui peuvent inhiber la NADPH oxydase dans les études sur les cellules en culture [108, 109, 110]. La curcumine, l'EGCG, les acides phénoliques, la capsaïcine, la quercétine, les anthocyanes et le resvératrol inhibent la xanthine oxydase, une enzyme liée à la formation de ROS chez la souris et à des expériences in vitro [111, 112, 113, 114, 115, 116]. En plus de cela, des preuves in vivo, la curcumine peut stimuler la production de SOD, de catalase et de glutathion peroxydase, des enzymes antioxydantes associées à une diminution de la formation de ROS [117]. L'EGCG améliore l'activité de la SOD et de la glutathion peroxydase, in vivo [118]. Modulation des cytokines La modulation des cytokines inflammatoires est l'un des mécanismes d'immunomodulation des polyphénols les plus étudiés [9]. Leurs propriétés sur les macrophages ont été observées dans une étude sur modèle animal avec administration de propolis chinoise dans des macrophages de rongeurs «RAW 264.7». Les polyphénols présents dans la propolis chinoise ont induit une inhibition de la cyclooxygénase 2 (COX 2) et de l'oxyde nitrique synthase inductible (iNOS) et une réduction conséquente de l'expression du TNF-α, IL-1β et IL-6 [119]. De même, ce phénomène a également été observé lors de l'administration d'extrait de camomille et de quercétine seule [120]. En outre, une étude clinique a souligné que l'huile d'olive extra vierge a été associée à la réduction de l'expression de l'IL-6 et de la protéine C-réactive (CRP) [121]. La quercétine et les catéchines ont un effet sur l'équilibre de la production de cytokines pro et anti-inflammatoires dans les études in vitro, augmentant la libération d'IL-10 et inhibant le TNF-α et l'IL-1 β [122, 123]. Voies de signalisation NF-kB Les polyphénols peuvent moduler le NF-kB à différents moments de la cascade d'activation, ce qui induit un effet anti-inflammatoire important par une altération de la liaison du complexe NF-kB à l'ADN, à titre d'exemple [9]. En outre, dans une étude précédente, un phénomène similaire a été observé lorsque la quercétine était administrée dans des cellules microgliales BV-2 de rongeurs [124]. La galangine, un flavonoïde présent dans la propolis, peut contrôler la translocation de NF-kB et par conséquent diminuer l'expression de TNF-α, IL-6, IL-1β et IL-8 [125]. Au moins dans les études développées en culture cellulaire, d'autres polyphénols impliqués dans les voies de signalisation du NF-kB sont le resvératrol, les catéchines et les épicatéchines [126, 127]. En outre, il est important de souligner le rôle de l'EGCG sur l'inhibition de NF-kb des cellules épithéliales respiratoires du rat Wistar [128, 129], une fois qu'il pourrait améliorer les connaissances scientifiques entre les propriétés des composés bioactifs et le contrôle de la pandémie COVID-19.
Surtout dans l'infection virale, il est important de mettre en évidence une découverte dans l'étude des cellules de culture humaine et l'intervention de curcumine [130]. Ce polyphénol a fourni un effet antiviral contre les virus enveloppés, inhibant la réplication des virus Zika et Chikungunya. Cela peut s'expliquer par le fait que la curcumine peut interférer avec la liaison virus-cellule, réduisant son infectivité [130]. Il est à noter que seule une alimentation saine, variée et à base de fruits et légumes est en mesure d'assurer une exposition à tous ces composés bioactifs [89]. De cette manière, un approvisionnement adéquat en composés bioactifs et en micronutriments est garanti, ainsi que la synergie entre les vitamines et les minéraux [7, 8]. Le tableau 2 résume les principales fonctions de certains composés bioactifs et les sources de nourriture dans lesquelles ils se trouvent. Pour une meilleure compréhension de tous les mécanismes cités dans cet article, la figure 3 montre sur quel point de la voie d'infection par le SRAS-CoV-2 les principaux polyphénols et micronutriments immunomodulateurs peuvent agir. La carence en vitamine D, qui est assez répandue dans la population générale et en particulier chez les personnes âgées, induit une réponse immunitaire altérée à la vaccination antigrippale [135]. La littérature montre également que la supplémentation en vitamine D est associée à l'amélioration de la réponse immunitaire des patients atteints de cette carence en vitamines [136]. Konijeti et coll. [136] et Hemilä [137] ont démontré que la supplémentation en vitamine E peut être capable de réduire l'incidence de la pneumonie chez les hommes adultes et âgés [137]. Bouamama et coll. [138] ont indiqué que la supplémentation en vitamines C et E améliorait la réponse des lymphocytes T chez les personnes âgées et pourrait contribuer à la prévention de l'affaiblissement du système immunitaire lié à l'âge.


 Forum Nutrimuscle, Nutrition, musculation, transparence !
Forum Nutrimuscle, Nutrition, musculation, transparence !  Actualités, vidéos, études scientifiques
Actualités, vidéos, études scientifiques
![]() par Nutrimuscle-Conseils » 26 Déc 2020 15:54
par Nutrimuscle-Conseils » 26 Déc 2020 15:54 ![]() par Nutrimuscle-Conseils » 26 Déc 2020 15:55
par Nutrimuscle-Conseils » 26 Déc 2020 15:55 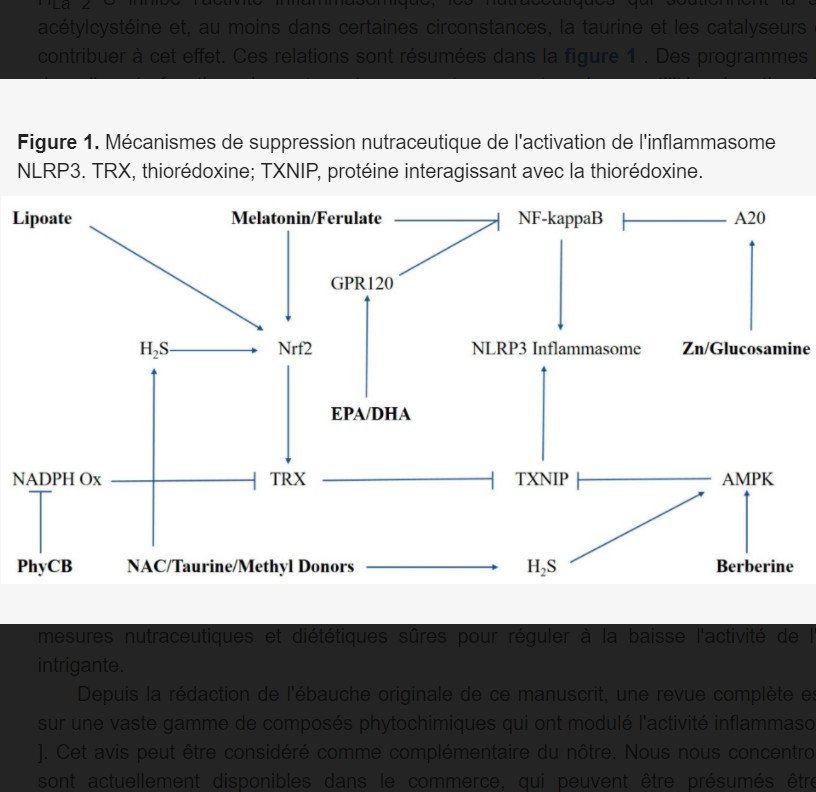
![]() par Nutrimuscle-Diététique » 26 Déc 2020 16:54
par Nutrimuscle-Diététique » 26 Déc 2020 16:54 ![]() par Nutrimuscle-Conseils » 1 Jan 2021 14:48
par Nutrimuscle-Conseils » 1 Jan 2021 14:48 ![]() par Nutrimuscle-Diététique » 1 Jan 2021 15:35
par Nutrimuscle-Diététique » 1 Jan 2021 15:35 ![]() par Nutrimuscle-Conseils » 4 Jan 2021 00:06
par Nutrimuscle-Conseils » 4 Jan 2021 00:06 
![]() par Nutrimuscle-Conseils » 5 Jan 2021 19:03
par Nutrimuscle-Conseils » 5 Jan 2021 19:03 
![]() par Nutrimuscle-Conseils » 5 Jan 2021 19:04
par Nutrimuscle-Conseils » 5 Jan 2021 19:04 
![]() par Nutrimuscle-Conseils » 5 Jan 2021 19:08
par Nutrimuscle-Conseils » 5 Jan 2021 19:08 
![]() par Nutrimuscle-Conseils » 15 Jan 2021 21:55
par Nutrimuscle-Conseils » 15 Jan 2021 21:55 ![]() par Nutrimuscle-Conseils » 23 Fév 2021 12:23
par Nutrimuscle-Conseils » 23 Fév 2021 12:23 ![]() par Nutrimuscle-Conseils » 23 Fév 2021 12:30
par Nutrimuscle-Conseils » 23 Fév 2021 12:30 ![]() par Nutrimuscle-Conseils » 23 Fév 2021 12:30
par Nutrimuscle-Conseils » 23 Fév 2021 12:30 ![]() par Nutrimuscle-Diététique » 23 Fév 2021 17:20
par Nutrimuscle-Diététique » 23 Fév 2021 17:20 ![]() par Nutrimuscle-Diététique » 23 Fév 2021 17:21
par Nutrimuscle-Diététique » 23 Fév 2021 17:21 










